Les cardiomyopathies hypertrophiques (CMH)
Dr Pierre-Yves TARLET, Centre Hospitalier Intercommunal de Compiègne Noyon, Compiègne
Août 2022
Introduction
On définit par cardiomyopathie hypertrophique (CMH) toute hypertrophie d’au moins 15 mm d’un segment du ventricule gauche, en l’absence de conditions de charge anormales et suffisantes pour l’expliquer. Ce seuil peut être baissé à 13 mm en cas d’histoire familiale de CMH. (1)
Cette hypertrophie peut être le reflet de nombreuses maladies qui peuvent être classées de la façon suivante :
- Les CMH sarcomériques, résultant d’une mutation d’un gène du sarcomère (unité de base du myofibrille) : environ 40 à 60% des CMH.
- Les CMH idiopathiques : environ 30%
- Un groupe hétérogène intégrant des maladies de surcharge en glycogène (maladie de Danon, maladie de Pompe), de surcharge lysosomale (maladie de Fabry), de maladies infiltratives (amylose), des maladies neuromusculaires, des cardiopathies endocriniennes ou secondaires à des traitements.
I. Les CMH sarcomériques
Les CMH sarcomériques touchent environ 2 personnes sur 1000 dans la population générale. Elles sont secondaires à des mutations affectant des gènes responsables du bon fonctionnement du sarcomère (une quarantaine identifiées actuellement). Cette perte de fonctionnalité va s’accompagner d’une d’hypertrophie compensatrice qui va intéresser initialement essentiellement le septum interventriculaire. Ces mutations se transmettent de générations en générations selon un mode autosomique dominant (affectant autant les femmes que les hommes), ont une pénétrance incomplète (être porteur de la mutation ne signifie pas forcément que l’on va développer la maladie), et n’ont pas toutes les mêmes répercussions pronostics.
De par la proximité avec la chambre de chasse ventriculaire gauche, un bourrelet septal va pouvoir constituer un obstacle à l’éjection du sang dans l’aorte lors de la systole, il en résulte l’apparition d’un gradient intraventriculaire gauche. Par effet Venturi, ce gradient va pouvoir « aspirer » la grande valve mitrale, occasionnant une insuffisance mitrale. Cet effet est connu sous la dénomination anglaise de Systolic Anterior Motion ou SAM. (2)
Cliniquement, la symptomatologie rapportée par le patient est très peu spécifique. Il peut s’agir d’un angor d’effort, d’une dyspnée, de palpitations, de syncope à l’effort. Il en est de même pour l’examen physique avec au plus un souffle systolique au foyer aortique en cas de gradient intraventriculaire gauche, ou encore des signes congestifs en cas d’insuffisance cardiaque.
Les examens utiles au diagnostic vont comporter :
- L’ECG, en mettant en évidence une HVG électrique (indice de Cornell : RVL + SV3 > 20 mm chez la femme ou > 28 mm chez l’homme) avec des troubles de la repolarisation en rapport.
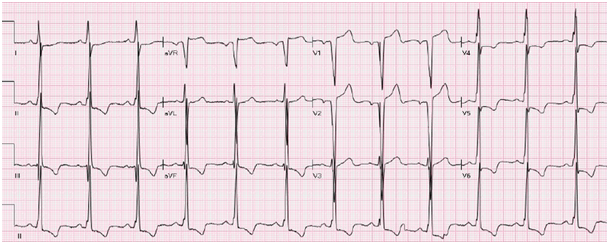
Fig 1 : Aspect ECG d’une CMH avec indice de Cornell à 28 mm et troubles de la repolarisation marqués par une négativation des ondes T en inférieur et inféro-latéral
-
L’échocardiographie (ETT), examen clé au diagnostic en permettant de mesurer l’épaisseur pariétale, d’analyser la répartition de l’hypertrophie (sur le VG, sur le VD), de rechercher un gradient intra-VG ou un SAM.
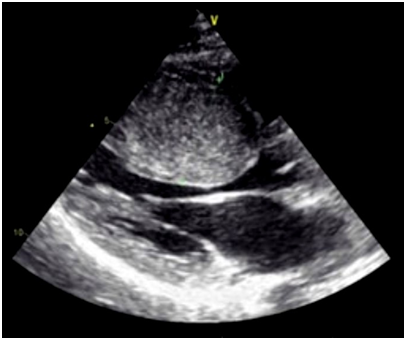
Fig 2 : Aspect échocardiographique d’une cardiopathie hypertrophique sarcomérique marquée par une importante hypertrophie septale
- L'IRM myocardique, avec les mêmes applications que l’ETT mais en permettant d’apporter d’avantages d’informations en termes d’orientation étiologique, ou d’indices pronostics.
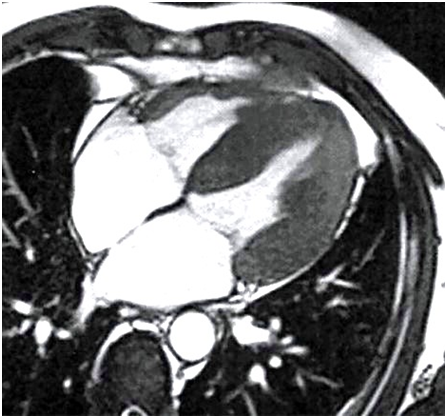
Fig 3 : Aspect IRM d’une cardiomyopathie hypertrophique
- L'analyse génétique, en permettant d’identifier la mutation causale, va permettre de proposer la mise en place d’un dépistage familial.
L’évolution de la CMH est marquée par un risque élevé de mort subite, notamment chez le sujet jeune. Avec l’âge, va apparaitre une insuffisance cardiaque à fraction d’éjection ventriculaire gauche (FEVG) préservée, puis à terme une cardiomyopathie dilatée.
La prise en charge thérapeutique va reposer sur la prévention et le traitement de la mort subite ainsi que sur le traitement des symptômes :
La prévention de la mort subite repose sur la restriction des activités sportives aux seules activités aérobies de faible intensité. La mise en place d’un Défibrillateur Automatique Implantable (DAI) est systématique en prévention secondaire (TV soutenue avec retentissement hémodynamique ou FV récupérée). En prévention primaire, la décision repose sur un score de risque issu des recommandations ESC 2014, basé sur 7 paramètres : l’âge, l’épaisseur septale, la taille de l’oreillette gauche (OG), le gradient intra-VG au repos et après manœuvre de Valsalva, la survenue de TVNS, la survenue de syncopes inexpliquées ou encore un antécédent familial de mort subite. Un risque de mort subite estimé > 6% à 5 ans au travers de ce score est retenu afin de mettre en place un DAI. (3)
La prise en charge des symptômes va reposer sur la lutte contre le gradient intra-VG. En première intention, les bétabloquants non vasodilatateurs type PROPANOLOL ou BISOPROLOL peuvent être initiés. En cas d’arythmie ventriculaire, le CORGARD permettrait d’assurer une meilleure couverture. Le DISOPYRAMIDE (antiarythmique de classe IA) peut être associé aux bétabloquants. En seconde ligne, peut être proposé chez les patients restant symptomatiques NYHA III-IV avec gradient intra-VG maximal > 50 mmHg spontanément ou de façon provoquée (Valsalva ou échographie d’effort) malgré un traitement médical optimal, une réduction septale. Celle-ci peut se faire chirurgicalement, il s’agit de la myotomie-myectomie de Morrow et Bigelow, soit de façon interventionnelle au travers de l’alcoolisation septale (injection d’alcool dans la première branche septale au cours d’une coronarographie) qui est associée à un risque élevé (de l’ordre de 20%) de mise en place d’un stimulateur cardiaque pour BAV. De façon historique, la mise en place d’un stimulateur cardiaque avec sonde VD positionnée à l’apex, était proposée aux patients ne relevant pas d’une réduction septale, ceci permettait d’obtenir un asynchronisme intra-VG et ainsi de réduire le gradient intra-VG.
II) La maladie d’Anderson-Fabry
La maladie d’Anderson-Fabry résulte d’une déficience enzymatique congénitale, avec une incidence d’une personne sur 40.000, secondaire à une mutation du gène GLA situé sur le chromosome X, l’alpha galactosidase A, responsable de la dégradation des sphingolipides. Il en résulte une accumulation de globotriaosylcéramide (ou Gb3) dans les lysosomes des cellules (sorte de poubelle cellulaire), essentiellement les cellules endothéliales, musculaires lisses vasculaires et les cardiomyocytes. Peuvent ainsi être touchés :
- le rein, donnant lieu à des glomérulopathies avec en général nécessité du recours à la dialyse vers 40 ans,
- le cœur, occasionnant une CMH et prédisposant au développement de fibrillation atriale (FA) et de troubles conductifs de haut degré,
- les nerfs et le cerveau, responsable de douleurs chroniques à type de brûlures, de paresthésies ou encore d’AVC,
- la peau, donnant un aspect d’hyper-kératose péri-ombilicale, génitale et fessière, et prédisposant à l’hypohydrose ;
- l’œil, avec l’apparition d’opacités cristalliniennes et cornéennes, donnant un aspect de cornée « verticillée » (cornée tourbillonnante lors de l’examen à la lampe à fente).
- le système cochléo-vestibulaire, responsable d’acouphènes, de vertiges ou d’hypoacousie.
Les formes hétérozygotes chez la femme se limitent aux signes dermatologiques et oculaires.
Les examens utiles au diagnostic vont comporter :
- l’ECG qui va pouvoir mettre en évidence une hypertrophie ventriculaire gauche (HVG) électrique, un PR court, une bradycardie sinusale.
- L’ETT va retrouver une cardiopathie hypertrophique à prédominance postérieure avec hypertrophie touchant les piliers mitraux, associée à une hypertrophie ventriculaire droite.
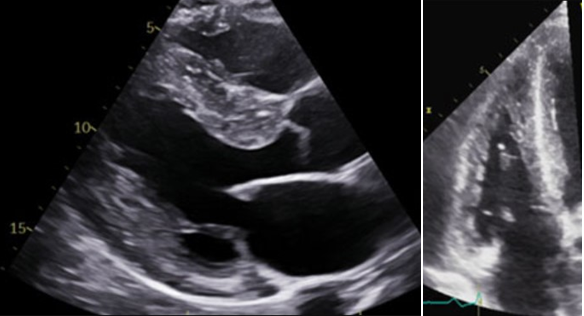
Fig 4 : Aspect échocardiographique d’une maladie de Fabry en coupe parasternale grand axe (à gauche) et en coupe apicale 4 cavités centrée sur les cavités droites (à droite)
- L’IRM myocardique va retrouver un rehaussement tardif inféro-latéral, une réduction du signal T1, une élévation du signal T2.
- Le dosage de l’activité de l’alpha galactosidase A dans les leucocytes.
- La recherche de la mutation (notamment chez la femme chez qui l’activité enzymatique peut être normale dans les formes hétérozygotes).
La réalisation d’un dépistage familial par dosage enzymatique chez les hommes, et le génotypage GLA chez la femme est indispensable après identification d’un cas index.
Le pronostic est conditionné par les complications cardiologiques, néphrologiques et cérébrales de la maladie, réduisant en l’absence de traitement l’espérance de vie de 20 ans chez les hommes et de 10 ans chez les femmes.
Le traitement repose sur la substitution enzymatique par de l’alpha-galactosidase A recombinante in vitro, en perfusion toutes les 2 semaines, permettant de réduire les atteintes rénales et le degré d’hypertrophie VG. Le recours à la stimulation cardiaque n’est pas rare du fait des troubles conductifs évolutifs. Du fait de son association avec une hyperexcitabilité ventriculaire, selon les recommandations ESC, la mise en place d’un DAI à la place d’un stimulateur doit s’envisager en cas d’HVG ou de fibrose sévère (IIa), d’HVG sévère et de fibrose étendue ou rapidement progressive (IIb), d’HVG sévère et de syncope inexpliquée ou de TVNS objectivée.
III) L’amylose cardiaque
L’amylose est une pathologie secondaire à l’accumulation dans le secteur extracellulaire de protéines « amyloïdes », dont l’on reconnait aujourd’hui trois grandes familles (4) :
- L’amylose AL lorsque la protéine est une chaine légère d’immunoglobuline clonale intégrée dans une gammapathie.
- L’amylose à transthyrétine (TTR) qui comme son nom l’indique correspond à une accumulation de Transthyrétine, protéine produite par le foie. On distingue les formes héréditaires secondaire à une mutation génétique, des formes « sauvages », retrouvées en général chez des patients très âgés, d’où l’ancienne nomenclature d’amylose « sénile ».
- L’amylose AA rencontrée dans le cadre de syndromes inflammatoires prolongés, consécutive à l’accumulation de la protéine inflammatoire SAA.
Les manifestations cliniques vont être en lien avec l’accumulation de cette protéine dans divers organes : macroglossie, hématome péri-orbitaire, syndrome du canal carpien, neuropathie périphérique… Il n’existe pas de signe clinique spécifique en faveur d’une amylose cardiaque, on peut en effet retrouver des signes d’insuffisance cardiaque, des troubles du rythme supraventriculaire, un souffle de RAC (20% des patients bénéficiant d’un TAVI présentent une amylose cardiaque). (5)
Les examens utiles au diagnostic vont comporter :
- L’ECG qui va révéler un microvoltage des QRS paradoxal compte tenu de l’existence d’une cardiopathie hypertrophique, des pseudo-ondes Q de nécrose, des troubles conductifs à type de blocs atrio-ventriculaires (BAV).
- L’ETT qui va retrouver une cardiopathie hypertrophique intéressant les deux ventricules avec un myocarde paraissant scintillant, un épaississement des feuillets valvulaires, un flux transmitral restrictif, une dilatation du massif atrial, une lame d’épanchement péricardique, un gradient de strain longitudinal d’avantage préservé au fur et à mesure que l’on se rapproche de l’apex.
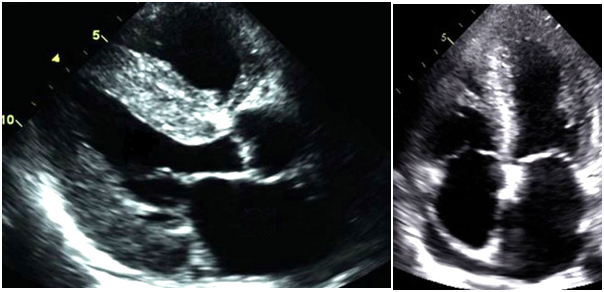
Fig 5 : Aspect échocardiographique d’une amylose cardiaque en coupe parasternale grand-axe (à gauche) et en coupe apicale 4 cavités (à droite)
- L’IRM myocardique qui si elle était réalisée, révélerait les mêmes signes morphologiques que l’ETT, avec en plus un rehaussement tardif sous endocardique ou transmural en « tâches », une augmentation du T1 natif ainsi que du volume extracellulaire.
Lorsque le diagnostic d’amylose est suspecté sur l’un de ces éléments, le diagnostic positif et étiologique repose sur l’algorithme suivant :
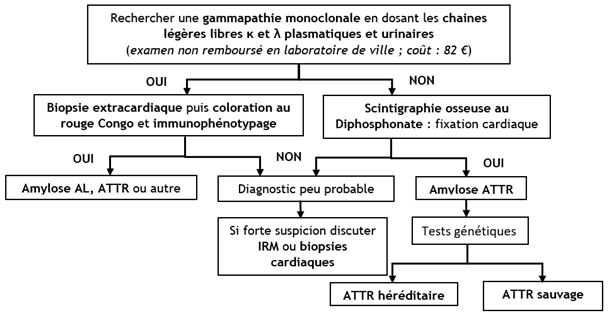
Fig 6 : Algorithme diagnostique pour le diagnostic de l’amylose cardiaque (6)
En résumé, le diagnostic positif repose sur un faisceau d’arguments avec une orientation vers :
- une amylose AL si mise en évidence d’un pic monoclonal de chaines légères et une preuve histologique et immunologique mettant en évidence l’accumulation de ces chaines légères sous la forme de dépôts amyloïdes.
- une amylose à TTR, en l’absence de pic monoclonal et avec une fixation cardiaque du Diphosphonate à la scintigraphie. Une fois le diagnostic confirmé, un conseil génétique est systématique, et ce quel que soit l’âge du patient.
La prise en charge de l’amylose cardiaque repose sur le traitement de l’insuffisance cardiaque et sur le traitement spécifique du type d’amylose. (7)
La prise en charge de l’insuffisance cardiaque amyloïde présente certaines particularités en lien avec la fréquente mauvaise tolérance hémodynamique des traitements standards (bétabloquants et antagonistes du système rénine-angiotensine-aldostérone), ainsi qu’une marge étroite en termes de répercussion clinique d’une faible variation de volémie avec tendance à l’hypotension marquée en cas de faible hypovolémie, ou d’apparition de signes congestifs en cas de légère hypervolémie. L’ajustement répété des doses de diurétiques est donc primordial dans cette pathologie.
L’amylose cardiaque s’accompagne fréquemment de troubles du rythme supraventriculaires. L’introduction d’une anticoagulation efficace repose sur les mêmes principes d’évaluation du rapport risque ischémique/hémorragique, en prenant en compte un surrisque hémorragique modéré expliqué par l’atteinte vasculaire et du facteur X de la cascade de l’hémostase secondaire, fréquemment rencontrées dans la maladie. Les inhibiteurs calciques bradycardisants en se complexant aux protéines amyloïdes occasionnent une cardiotoxicité qui aggrave l’atteinte cardiaque. L’utilisation de la Digoxine doit être prudente chez ces patients présentant souvent une dysfonction rénale importante. La Cordarone reste un traitement bien toléré pouvant être utilisé tant sur le plan d’une tentative de cardioversion, que du contrôle chronotrope.
Les troubles conductifs sont également fréquents dans la maladie et peuvent correspondre aussi bien à de l’insuffisance chronotrope en lien avec une dysautonomie qu’il faudra rechercher en cas de dyspnée à l’effort sans explication hémodynamique, que de blocs sino-atriaux ou atrio-ventriculaires qu’il faudra s’évertuer à rechercher par des Holters répétés car une fois fixés, ces troubles s’accompagnent d’un véritable état de choc cardiogénique chez ces patients pour lesquels le débit cardiaque est conditionné quasiment exclusivement par la fréquence cardiaque. Une augmentation des arythmies ventriculaires a également été rapportée dans les amyloses AL.
Ces patients présentant un terrain de fragilité particulier, leur mise à jour vaccinale est indispensable (COVID, Pneumocoque, Grippe…)
Dans le cadre de l’amylose AL, le traitement va reposer sur des chimiothérapies (inhibiteur du protéasome, agent alkylant et immuno-modulateur) ou immunothérapie (Daratumumab) visant à traiter la gammapathie monoclonale avec pour objectif la normalisation du taux de chaines légères. Bien que la mise en place de ces traitements soit du recours de l’Hématologue, leur cardiotoxicité potentielle impose une surveillance cardiologique étroite.
L’amylose à transthyrétine, bénéficie depuis 2020 d’un traitement spécifique autorisé à la commercialisation en France, le VYNDAQEL ® (Tafamidis), après avoir démontré son efficacité en termes de réduction d’hospitalisation pour IC, de mortalité globale et de réduction de l’altération de la qualité de vie. Il joue le rôle de stabilisateur de la TTR. Il se présente sous la forme d’un comprimé de 61 mg à prendre quotidiennement.
IV) Les maladies du stockage du glycogène
Ce groupe de pathologies est représenté par deux entités :
- La maladie de Danon, secondaire à une mutation du gène LAMP2 exprimé sur le chromosome X et impliqué dans la production d’une protéine constituant la paroi lysosomale, se manifestant à partir de l’âge de 10 ans chez le garçon par la triade : myopathie squelettique, retard mental et CMH majeure pouvant s’associer à une pré-excitation ECG dans un tiers des cas. Les femmes sont plus rarement atteintes et la pathologie se révèle en général plus tardivement. Il n’existe pour l’heure pas de traitement spécifique de cette maladie.
- La maladie de Pompe, est une pathologie rare (incidence d’une naissance sur 150.000), due à une mutation du gène GAA (plus de 150 identifiées) présent sur le chromosome 17, se transmettant sur un mode récessif, codant pour la protéine Alpha Glucosidase Acide, chargée de transformer le glycogène en glucose. Elle a la particularité de pouvoir se révéler à tout âge, avec une atteinte d’autant plus sévère qu’elle est de révélation précoce (nourrisson). Tous les muscles de l’organisme sont atteints par cette pathologie, avec une prédilection pour le diaphragme, les muscles squelettiques puis le myocarde. Dans ce cas, l’hypertrophie est majeure et peut s’accompagner également d’un aspect de pré-excitation ECG. Le traitement repose sur une substitution enzymatique intra-veineuse toutes les deux semaines.
Références
(1) Hypertrophic Cardiomyopathy Guidelines, Eur Heart J (2014) 35:2733-2779 - doi/10.1093/eurheartj/ehu284
(2) Maron MS, Olivotto I, Betocchi S, Casey SA, Lesser JR, Losi MA, Cecchi F, Maron BJ. Effect of left ventricular outflow tract obstruction on clinical outcome in hypertrophic cardiomyopathy. N Engl J Med 2003;348:295–303.
(3) DeckerJA, RossanoJW, Smith EO, Cannon B, Clunie SK, GatesC, Jefferies JL, Kim JJ, Price JF, Dreyer WJ, Towbin JA, Denfield SW. Risk factors and mode of death in isolated hypertrophic cardiomyopathy in children. J Am Coll Cardiol 2009;54:250–254.
(4) Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med. 2003 Aug 7;349(6):583-96. doi: 10.1056/NEJMra023144. PMID: 12904524.
(5) Unveiling transthyretin cardiac amyloidosis and its predictors among elderly patients with severe aortic stenosis undergoing transcatheter aortic valve replacement; Castano A et al, European Heart Journal (2017) 38, 2879–2887
(6) Thibaud DAMY et al. Protocole National de Diagnostic et de Soins (PNDS) : Amyloses cardiaques, Filière CARDIOGEN, Centre de référence Amyloses Cardiaques 2020-2021
(7) Garcia-Pavia P, et al. Diagnosis and treatment of cardiac amyloidosis. A position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur J Heart Fail. 2021 Apr 7. doi: 10.1002/ejhf.2140. Online ahead of print.PMID: 33826207
Vous devez être connecté pour poster un commentaire
