L’échocardiographie cardiaque
Amandine Mailliet, infirmière en collaboration avec le Pr Sylvestre Maréchaux et le Dr Clémence Riolet, Groupement des Hôpitaux de l'Institut catholique de Lille
Janvier 2023
Introduction
L’exploration du cœur humain par les ultrasons remonte à 1952 et la première échocardiographie a été réalisée en 1955. L’échocardiographie est une technique d’imagerie, non irradiante et le plus souvent non invasive utilisant les propriétés physiques des ultrasons. Son utilisation s’est répandue en routine clinique pendant les années 1980-1990. L’échocardiographie est aujourd’hui un outil indispensable dans la pratique quotidienne du cardiologue en milieu hospitalier ou en ville. Il s’agit du stéthoscope du cardiologue moderne, facile d’accès et riche en informations car permet la visualisation dynamique du cœur (ses cavités, ses valves), des principaux vaisseaux thoraciques à la proximité immédiate du cœur comme l’aorte thoracique ascendante, les artères pulmonaires, la veine cave inférieure, les veines hépatiques et les veines pulmonaires, mais également via le Doppler, de caractériser les flux sanguins et le déplacement tissulaire au niveau cardiaque. Son utilité clinique est largement validée car il permet de poser rapidement un diagnostic, de stratifier le risque d’un patient et d’orienter une prise en charge thérapeutique.
L’échocardiographie Doppler Trans Thoracique (ETT)
Le patient, torse nu, devra être positionné en décubitus latéral gauche (vues parasternales et apicales) ou sur le dos (fenêtres suprasternale ou sous-costale). La sonde d’échocardiographie reliée à l’échographe sera placée sur le thorax (Figure 1). Celle-ci sera enduite d’un gel conducteur pour faciliter le passage des ultrasons à travers la peau. L’éclairage de la pièce devra être faible afin de permettre une analyse satisfaisante des images sur l’écran de l’échographe.
Figure 1 : un échographe
L’obtention d’un tracé ECG de bonne qualité, obtenu à partir de 3 électrodes et d’un câble relié à l’échographe, est indispensable durant l’examen pour pouvoir analyser les différentes structures anatomiques avec la phase du cycle cardiaque (systole ou diastole). Certains paramètres physiologiques comme la taille, le poids et la pression artérielle devront être recueillis, car beaucoup de paramètres obtenus sont interprétés à la lumière du morphotype du patient (valeurs indexées à la surface corporelle calculée à partir de la taille et du poids) et du niveau de pression artérielle.
1. Modalités techniques
L’examen échocardiographique est tout d’abord un examen morphologique dynamique. Il permet d’obtenir des coupes des structures cardiaques en 2 dimensions au cours du cycle cardiaque (Figure 2). Cette étude bidimensionnelle est la base de l’examen échocardiographique.
La technique TM (temps – mouvement) (Figure 3) représente le déplacement des structures cardiaques sur une ligne au cours du temps (méthode unidimensionnelle). L’imagerie tridimensionnelle, permettant l’obtention d’un volume 3D a longtemps été réservée à l’activité de recherche clinique mais est de plus en plus utilisée en routine clinique (Figure 4).
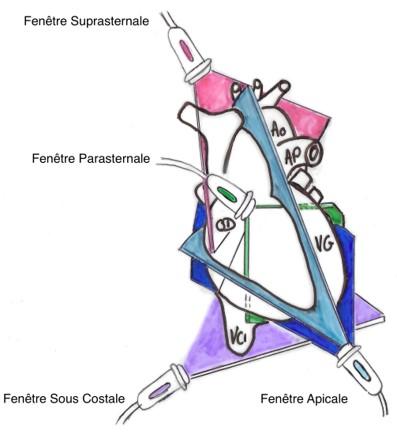
Figure 2 : principe de l’échocardiographie bidimensionnelle. Une coupe du cœur est réalisée comme indiqué sur le plan de coupe. Ao : Aorte, AP : artère pulmonaire ; VG : ventricule gauche ; OD : oreillette droite ; VCI : veine cave inférieure.
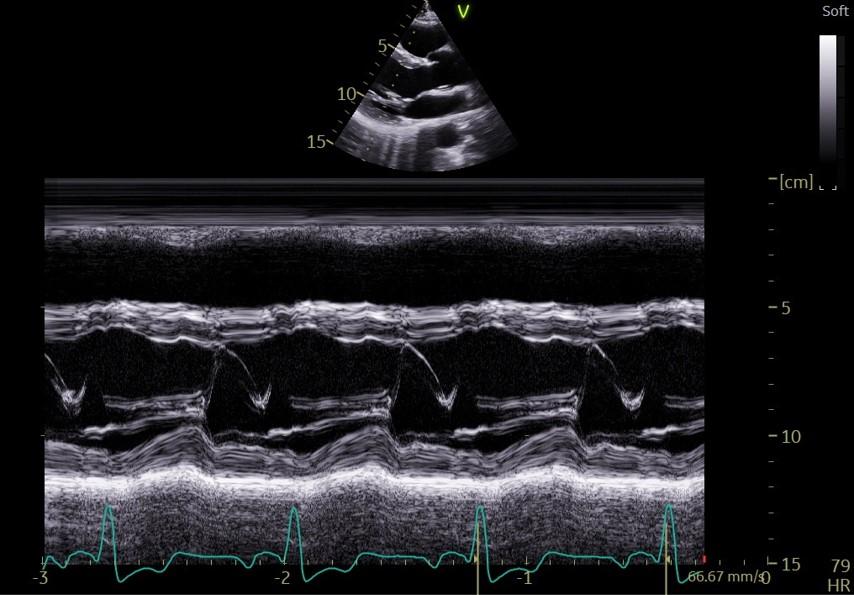
Figure 3 : Coupe TM parasternale grand axe du ventricule gauche
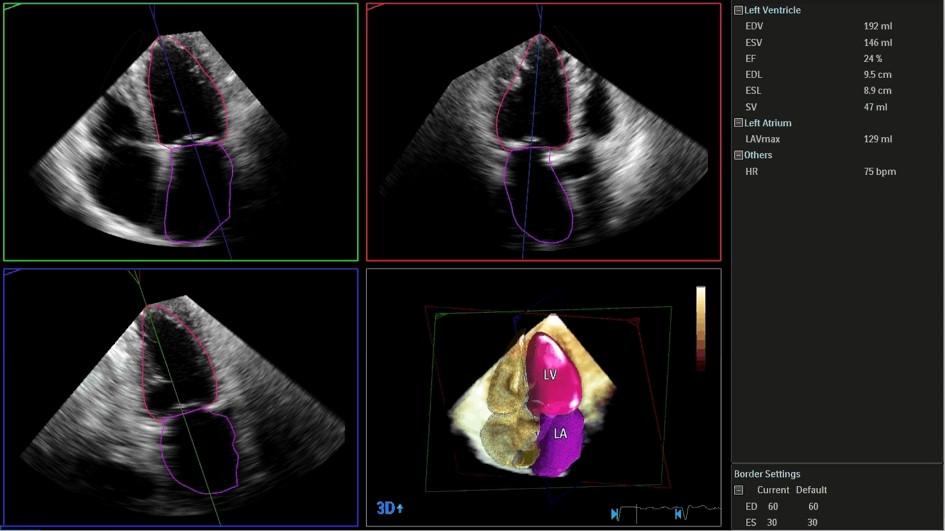
Figure 4 : Pyramide tridimensionnelle permettant une acquisition volumique incluant le ventricule gauche (LV), l’oreillette gauche (LA).
L’étude morphologique est couplée à une analyse Doppler, qui permet de mesurer la vitesse de déplacement du sang ou des structures cardiaques au cours du temps. Quatre techniques Doppler sont utilisées : le doppler pulsé (DP), le doppler continu (DC), le doppler couleur et le doppler tissulaire (DTI). Elles sont complémentaires. Les dopplers continu, pulsé et tissulaire sont représentés en échelle spectrale tandis que le Doppler couleur est représenté par une boite couleur ajoutée sur l’imagerie bidimensionnelle. Par convention, les flux qui s’approchent du capteur sont de couleur rouge en doppler couleur et positif en modes pulsé et continu. Les flux qui s’éloignent du capteur sont de couleur bleue en doppler couleur et présentés en négatif en modes pulsé et continu.
-Le DP permet de mesurer les vitesses de flux dans une zone spécifique (par exemple dans la chambre de chasse du ventricule gauche (VG) pour le calcul du volume d’éjection systolique) mais est limité par le phénomène d’aliasing qui empêche la mesure de vitesses au-dessus d’un certain seuil (classiquement, vitesse du flux sanguin supérieure à 1,5m/s). En pratique, on obtient un affichage spectral des vitesses (Figure 5). On peut ainsi obtenir la vitesse maximale du flux et l’Intégrale Temps Vitesse du flux (ITV) qui représente l’intégrale du flux obtenu par contourage à l’endroit exact de la position du curseur (par exemple l’ITV sous-aortique).
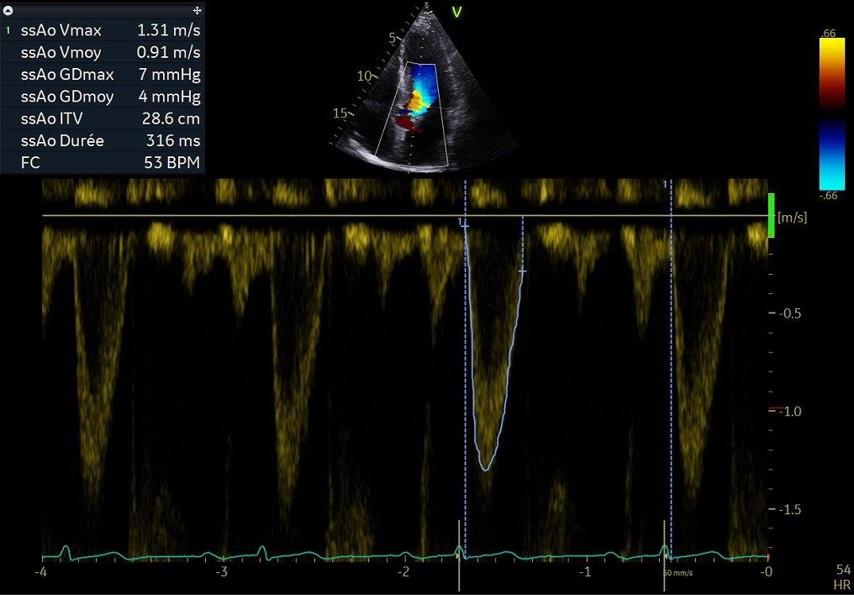
Figure 5 : Incidence apicale 5 cavités, doppler pulsé. Mesure de l’ITV en DP avec le curseur positionné en sous-aortique : ITV sous-aortique. Le flux est négatif car il s’éloigne du capteur V (éjection du ventricule gauche vers l’aorte). ssAo : sous-aortique, Vmoy : vitesse moyenne, Vmax : vitesse maximale, GDmax : gradient maximal, GDmoy : gradient moyen, ITV : Intégrale Temps-Vitesse, FC : fréquence cardiaque.
- Le DC émet et reçoit en continu des ondes ultra sonores. Il permet d’enregistrer des vitesses de flux très élevées (par exemple pour un flux aortique en cas de sténose ou pour un flux d’insuffisance tricuspide) mais il ne renseigne pas sur le point d’origine des vitesses le long du faisceau des ultrasons. On peut notamment ainsi obtenir la vitesse maximale du flux et l’ITV par contourage, dans l’alignement du faisceau d’ultrasons (et non sur un point spécifique) (Figure 6).
- Le doppler couleur utilise la technologie du DP avec un affichage des vitesses encodé en couleur et non sous forme spectrale. Il permet de manière très visuelle d’identifier l’origine, la direction et le type de flux (Figure 7).
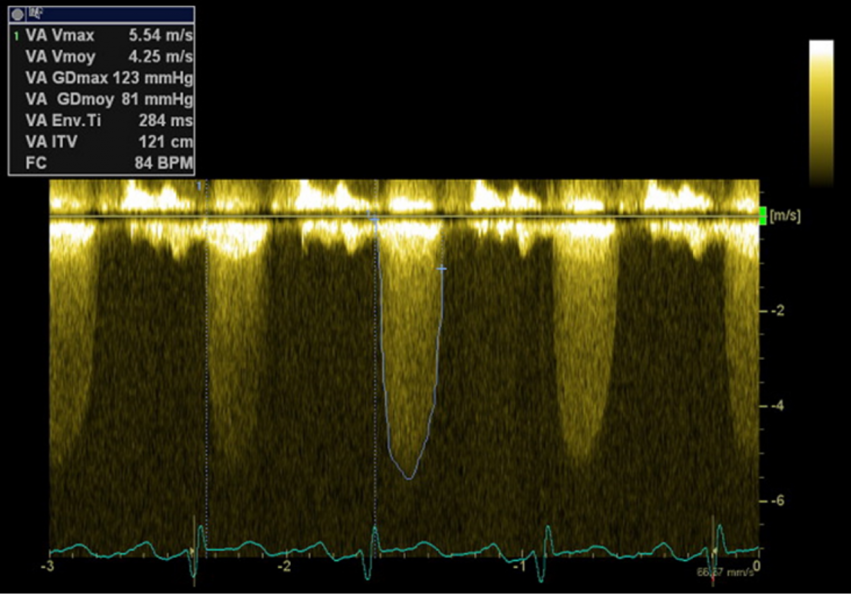
Figure 6 : Incidence apicale 5 cavités, Flux transvalvulaire aortique en doppler continu en cas de sténose aortique : mesure de la Vmax aortique et de l’ITV aortique. VA : valve aortique, Vmoy : vitesse moyenne, Vmax : vitesse maximale, GDmax : gradient maximal, GDmoy : gradient moyen, ITV : Intégrale Temps-Vitesse, FC : fréquence cardiaque.
-Le Doppler tissulaire (DTI) permet d’étudier le mouvement des parois myocardiques en se basant sur le décalage de fréquence de l’onde réfléchie sur le tissu myocardique. Il est surtout utilisé au niveau de l’anneau mitral pour l’évaluation de la diastole ventriculaire gauche et au niveau de l’anneau tricuspide pour évaluer son déplacement qui est un indice de fonction systolique du ventricule droit. On obtient ici une imagerie spectrale caractéristique (Figures 8 et 9), avec 2 ondes diastoliques e’ et a’ correspondant aux déplacements diastoliques du VG et S’correspondant au déplacement systolique).
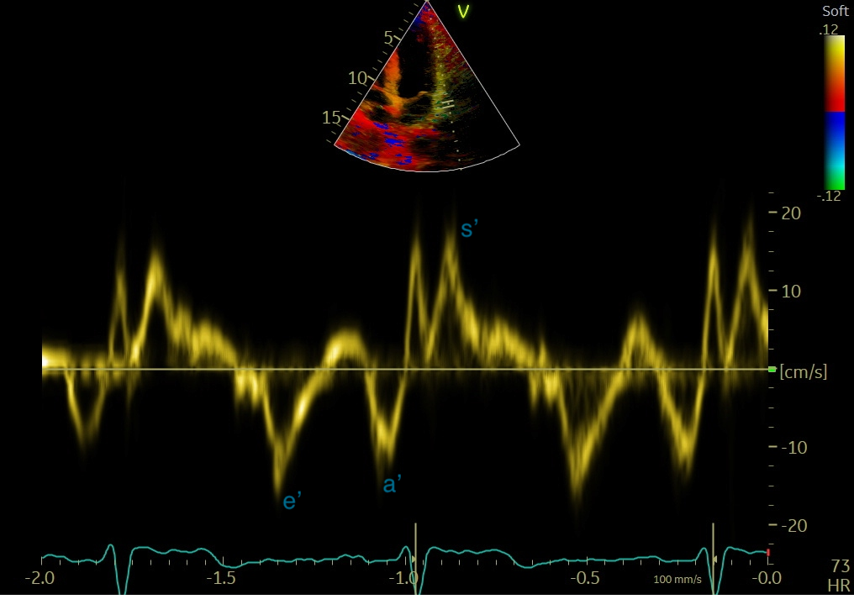
Figure 8 : Incidence apicale 4 cavités, Flux en Doppler pulsé tissulaire à l'anneau mitral latéral: curseur positionné à la base de la paroi latérale
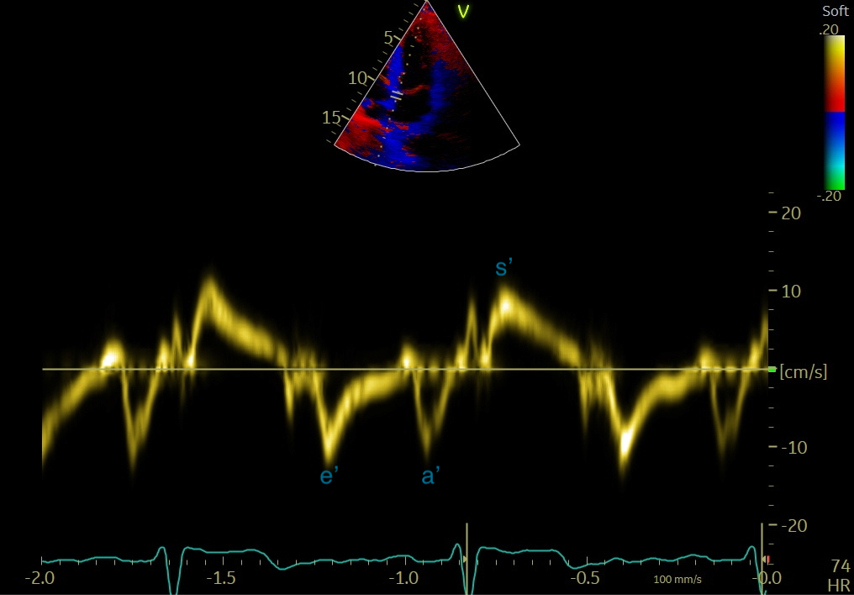
Figure 9 : Incidence apicale 4 cavités,Flux en Doppler pulsé tissulaire à l'anneau mitral septal : curseur positionné à la base de la paroi inféroseptale
2. Fenêtres d’explorations :
Les différentes modalités techniques sont utilisées selon les informations qui peuvent être obtenues sur chaque fenêtre d’exploration. Les différentes fenêtres sont :
-
- la fenêtre para sternale gauche
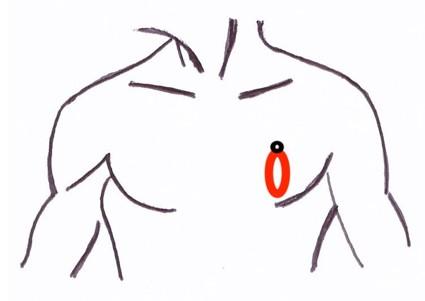
Figure 10 : Positionnement de la sonde d’échographie pour la fenêtre para sternale gauche,
le curseur de la sonde est orienté vers l’épaule droite du patient (coupe parasternale grand axe : PSGA)
ou vers l’épaule gauche du patient (coupe parasternale petit axe : PSPA)
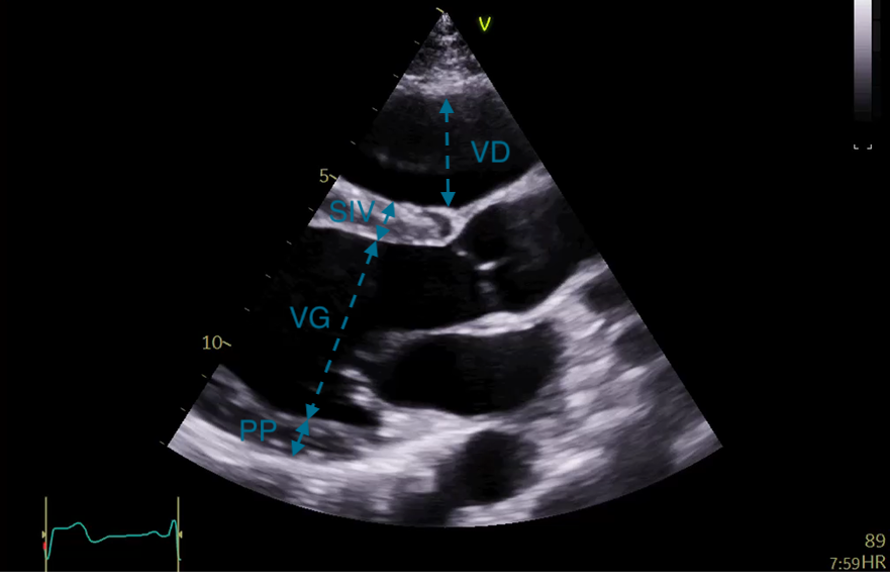
Figure 11: Coupe bidimensionnelle parasternale gauche grand axe (PSGA) en diastole. VD : ventricule droit ; VG : ventricule gauche ; SIV : Septum InterVentriculaire ; PP : Paroi Postérieure
La fenêtre parasternale grand axe (PSGA) permet de mesurer soit sur une acquisition bidimensionnelle (Figure 11), soit sur une acquisition TM (Figure 12), le diamètre du VG en télédiastole et en télésystole, les épaisseurs des parois (Figure 11), ce qui permet de calculer la masse ventriculaire gauche dérivée du diamètre et des épaisseurs diastoliques. La sonde doit être positionnée le plus haut possible pour obtenir une définition nette de la base du VG, le but de cette acquisition n’est pas de visualiser le VG jusqu’à l’apex. Ceci permet dans la majorité des cas de pouvoir réaliser une acquisition TM réellement perpendiculaire à la base du cœur, permettant une évaluation des mensurations du VG fiable. On pourra ainsi mettre en évidence une éventuelle hypertrophie ventriculaire gauche, c’est-à-dire une augmentation de la masse ventriculaire gauche. Elle permet de mesurer également en diastole, le diamètre de l’aorte ascendante au niveau des sinus de Valsalva, de la jonction sino-tubulaire et de l’aorte sus-jacente (Figure 13). Le diamètre de la chambre de chasse du VG juste au niveau de l’insertion des sigmoïdes aortiques sera mesuré en systole (Figure 14).
Cette coupe permet d’analyser le mouvement des valves mitrales et aortiques et de détecter la présence de fuites grâce au doppler couleur (Figure 15) ou de calcifications aux niveaux des valves aortiques et mitrales (Figure 16).
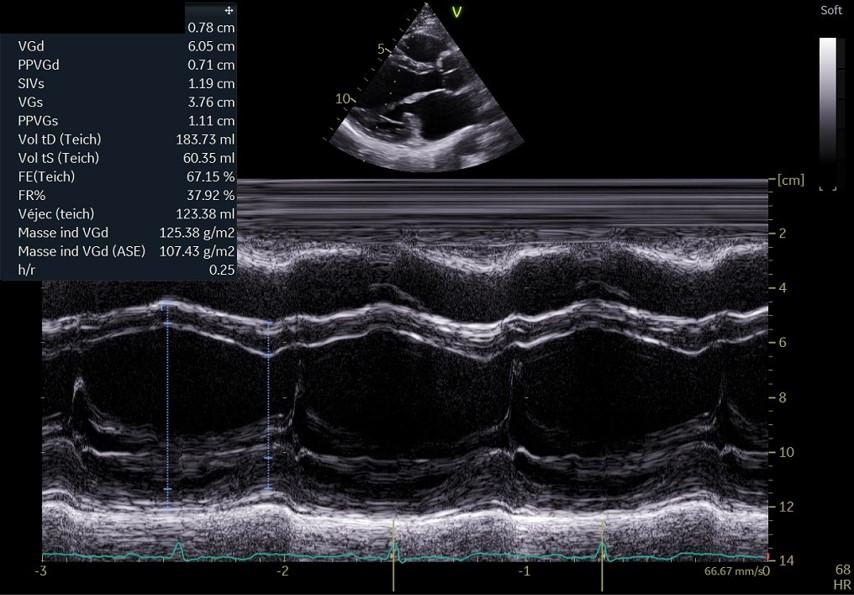
Figure 12 : Coupe TM, par voie PSGA: mesures du diamètre du VG et de ses épaisseurs pariétales. SIV : septum interventriculaire, VG : ventricule gauche, PP : paroi postérieure ou inférolatérale, d :diastole, s : sytole.
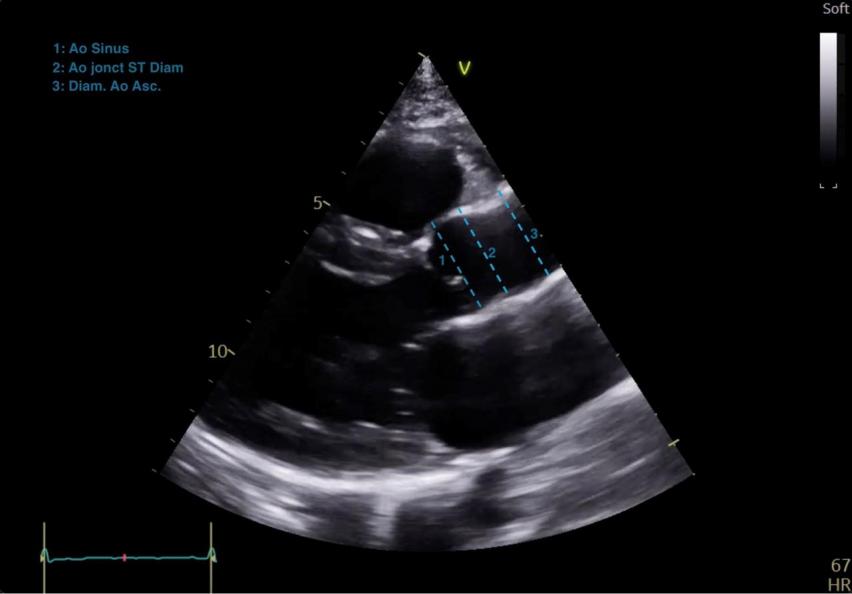
Figure 13 : Coupe PSGA: mesures des sinus de Valsalva (1), de la jonction sinotubulaire (2) et l’aorte tubulaire (3) en diastole
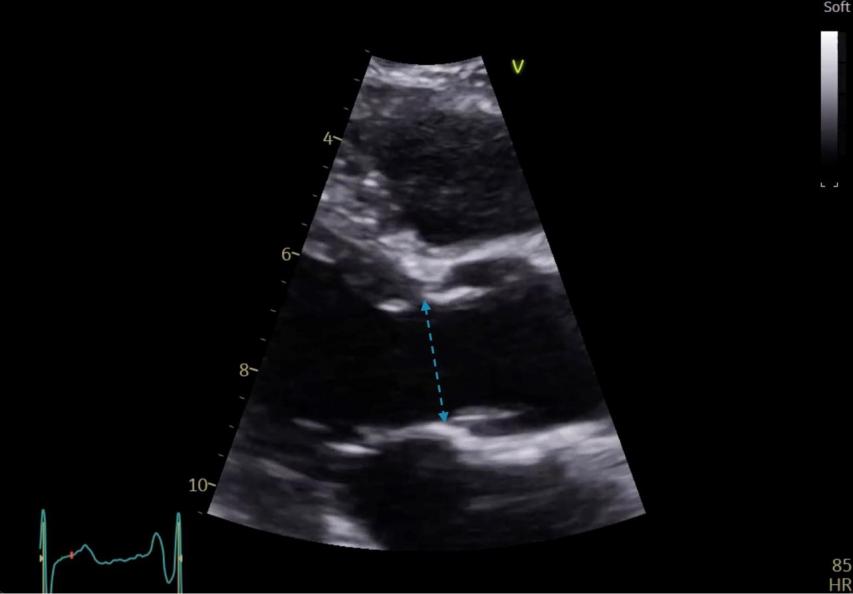
Figure 14 : Coupe PSGA: mesure de la chambre de chasse du VG en systole
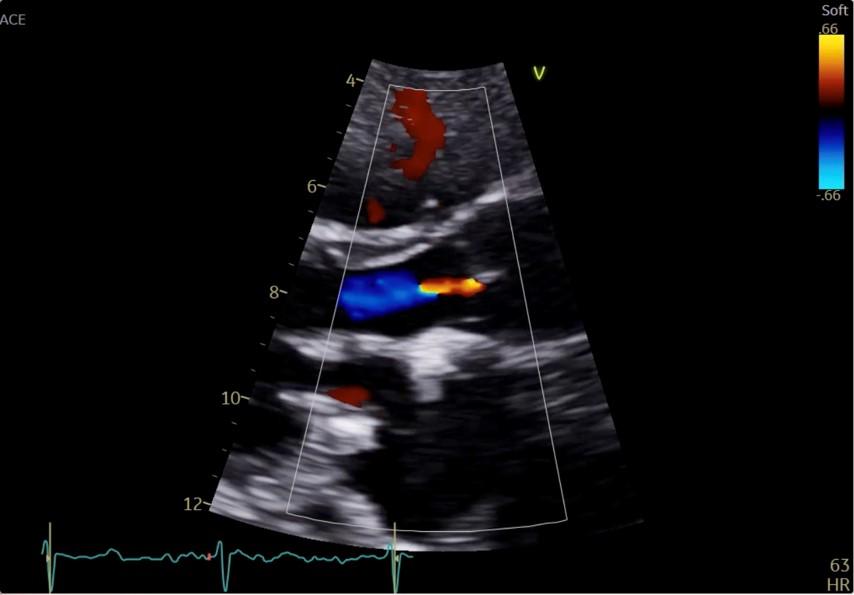
Figure 15 : Coupe PSGA zoomée sur la voie d’éjection ventriculaire gauche et la valve aortique. Flux Doppler couleur d’une fuite aortique centrale minime
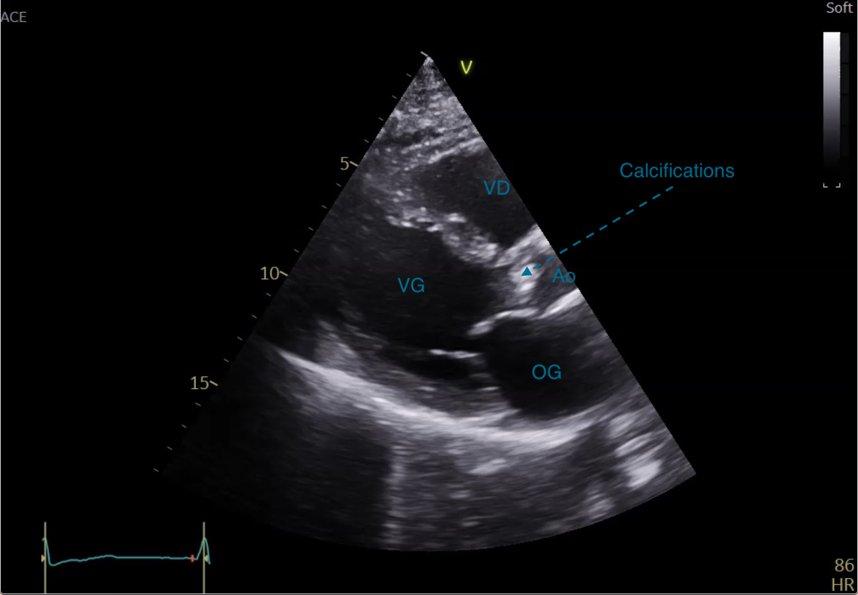
Figure 16 : Coupe PSGA. Calcifications de la valve aortique.
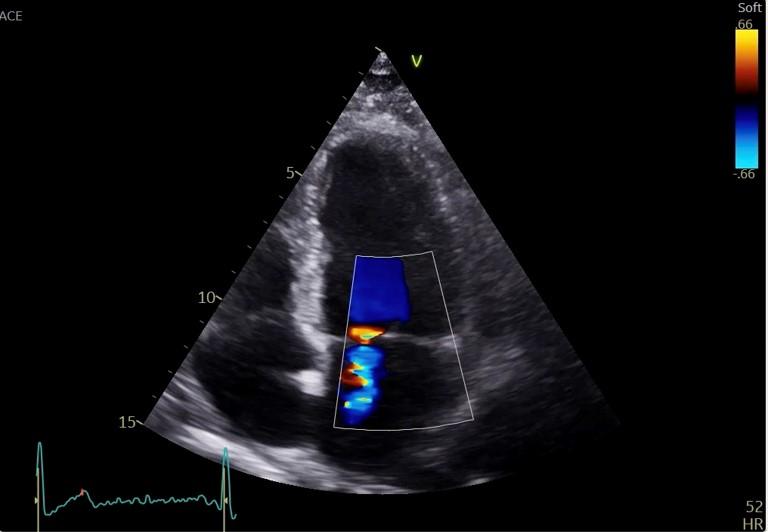
La fenêtre para sternale petit axe (PSPA), obtenue en tournant la sonde de 90° (curseur vers l’épaule gauche), permet de visualiser le VD, le VG qui apparaît sphérique ainsi que les piliers de la valve mitrale situés au niveau de la portion moyenne du VG (Figures 17). En orientant la sonde vers le haut dans la déplacer sur le thorax, on se dirige vers la base du coeur : on visualise d’abord la valve mitrale en « museau de poisson ». En continuant d’orienter vers le haut, on visualise la valve aortique (tricuspide, avec un signe de la « mercedes » typique, perdu en cas de bicuspidie aortique, cardiopathie congénitale la plus fréquente dans la population touchant 1 à 2% de la population) et l’artère pulmonaire (Figure 18). On peut également visualiser la valve tricuspide et les 2 oreillettes avec le septum interatrial. En orientant la sonde au maximum vers le bas sans la déplacer sur le thorax, on visualise l’apex du coeur (Figure 19). Cette coupe permet en balayant du haut vers le bas sans déplacer la sonde de visualiser la cinétique du VG dans ses portions basale (centrée sur la valve mitrale - Figure 17b), moyenne (centrée sur les piliers mitraux - Figure 17a) et l’apex. Elle permet également de visualiser la taille du VD (plus petit que le VG).
L’utilisation du doppler couleur permet de visualiser la présence de fuites sur les différentes valves du coeur.
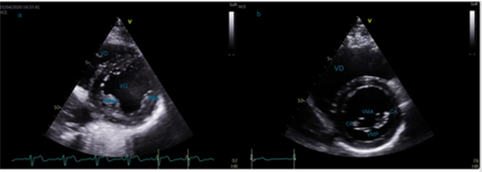
Figure 17a : Coupe PSPA passant par les piliers de la valve mitrale : portion moyenne du VG Figure 17b : Coupe PSPA passant par la valve mitrale en diastole
VD : ventricule droit ; VMA : feuillet antérieur de la mitrale (grande valve) ; VMP : feuillet postérieur de la mitrale (petite valve) ; CA : Commissure Antérieure (externe)
CP : Commissure Postérieure (interne) ; VG : ventricule gauche ; PPM : pilier postéromédian ; PAL : pilier antérolatéral
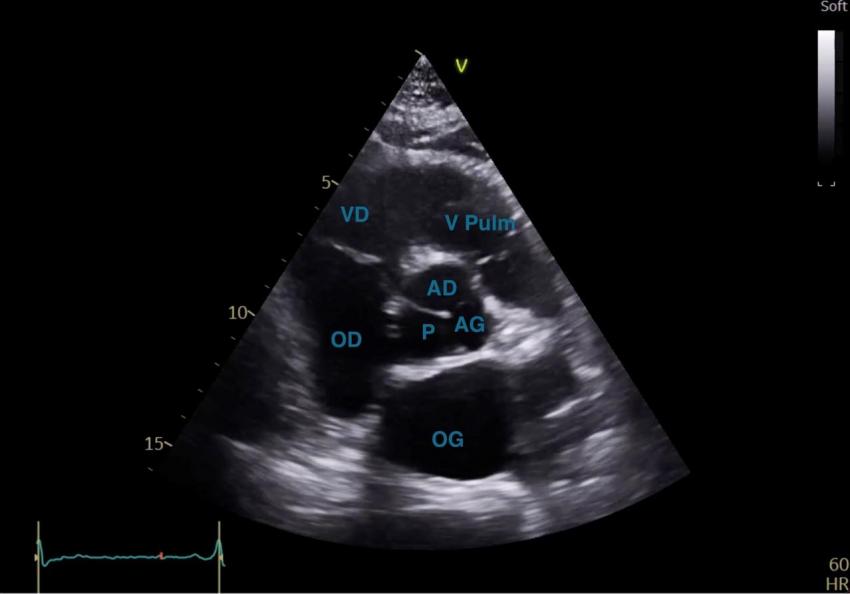
Figure 18 : Coupe PSPA centrée sur la valve aortique
VD : ventricule droit ; OD : oreillette droite ; OG : oreillette gauche ; V Pulm : valve pulmonaire
AD : sigmoïde aortique antéro-droite ; AG : sigmoïde aortique antéro-gauche
P : sigmoïde aortique postérieure ou non coronaire
Figure 19 : Coupe PSPA axée sur l’apex du VG
- la fenêtre apicale
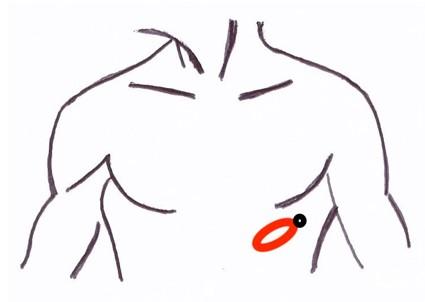 Figure 20 : Positionnement de la sonde d’échographie pour la fenêtre apicale. Le curseur de la sonde est orienté vers la gauche du patient, la sonde étant placée sous le mamelon.
Figure 20 : Positionnement de la sonde d’échographie pour la fenêtre apicale. Le curseur de la sonde est orienté vers la gauche du patient, la sonde étant placée sous le mamelon.
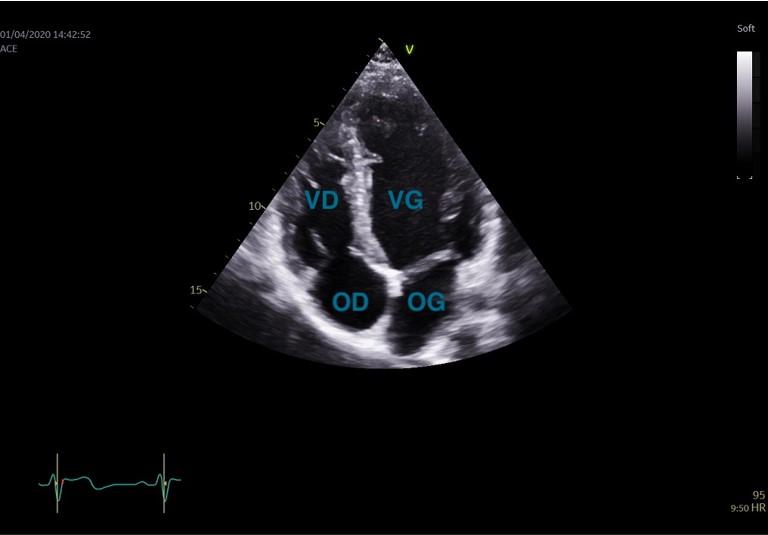
Figure 21 : Coupe Apicale, 4 cavités en télédiastole.
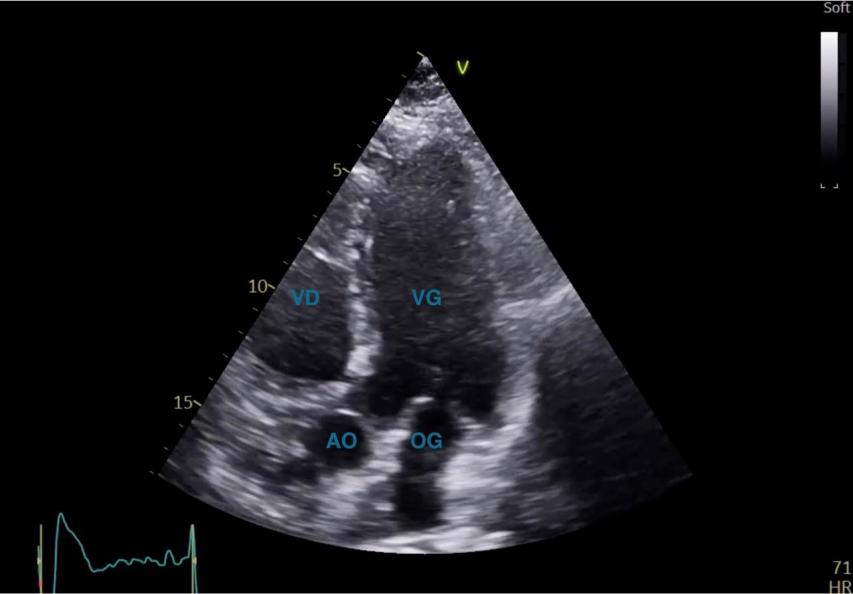
Figure 22 : Coupe apicale, 5 cavités en télédiastole
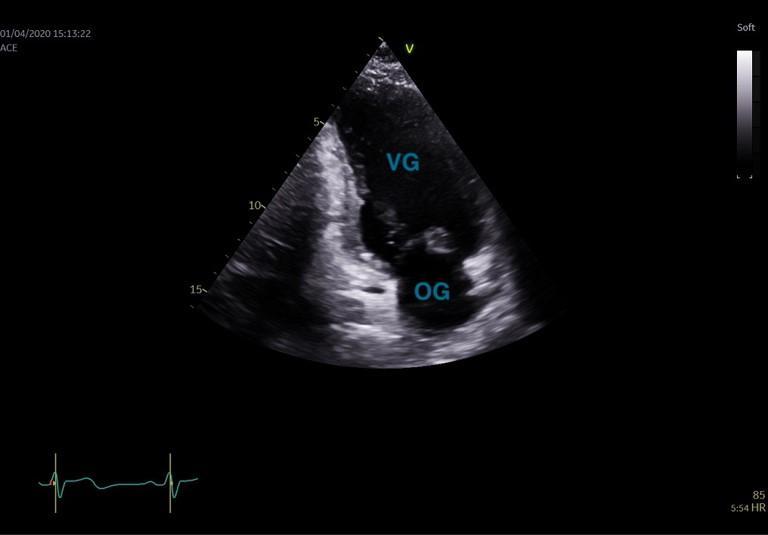
Figure 23 : Coupe apicale, 2 cavités en télédiastole
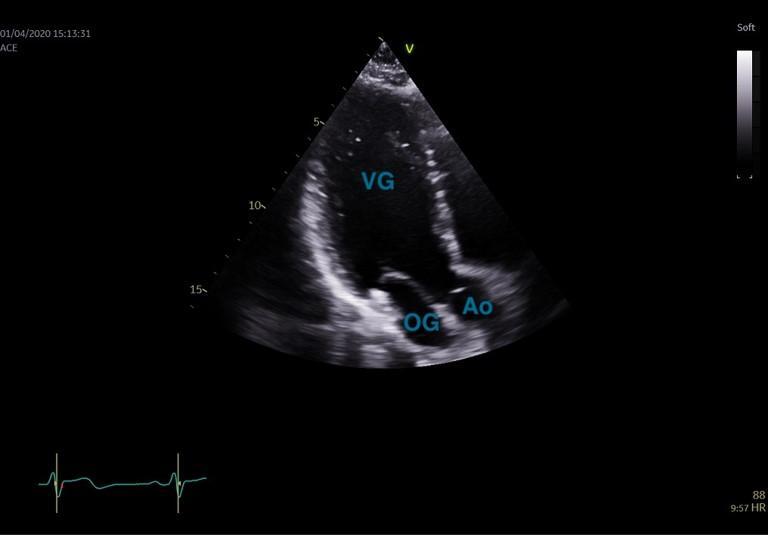
Figure 24 : Coupe apicale, 3 cavités en télédiastole
La coupe apicale 4 cavités est obtenue en positionnant la sonde sous le mamelon gauche, avec le curseur de la sonde orienté vers la gauche du patient (Figure 21). La coupe apicale 5 cavités est obtenue en orientant la sonde vers le haut et à droite à partir de l’apicale 4 cavités (Figure 22).
La coupe 2 cavités est obtenue après une rotation à 45° de la sonde vers la droite du patient à partir de l’apicale 4 cavités (Figure 23). La coupe apicale 3 cavités est obtenue avec la même orientation que la PSGA, ce qui correspond à une rotation de la sonde de 90° vers la droite du patient à partir de l’apicale 4 cavités (Figure 24). Il est important de descendre le plus possible en dessous du mamelon en faisant inspirer le patient pour cette acquisition apicale ; en effet, une acquisition trop haute expose à la troncature de l’apex et à une sous-estimation de la taille et des volumes cavitaires.
Les coupes 4, 2, 3 cavités permettent d’analyser la cinétique segmentaire du VG, d’analyser la fonction systolique ventriculaire du VG (Fraction d’éjection VG à partir des coupes 4 et 2 cavités, figures 21 et 23, normale > 50%), de mesurer le volume de l’OG (à partir des coupes 4 et 2 cavités, normale ≤ 34 mL/m², figures 21 et 23). La fonction systolique du ventricule droit peut être évaluée visuellement sur la coupe apicale 4 cavités.
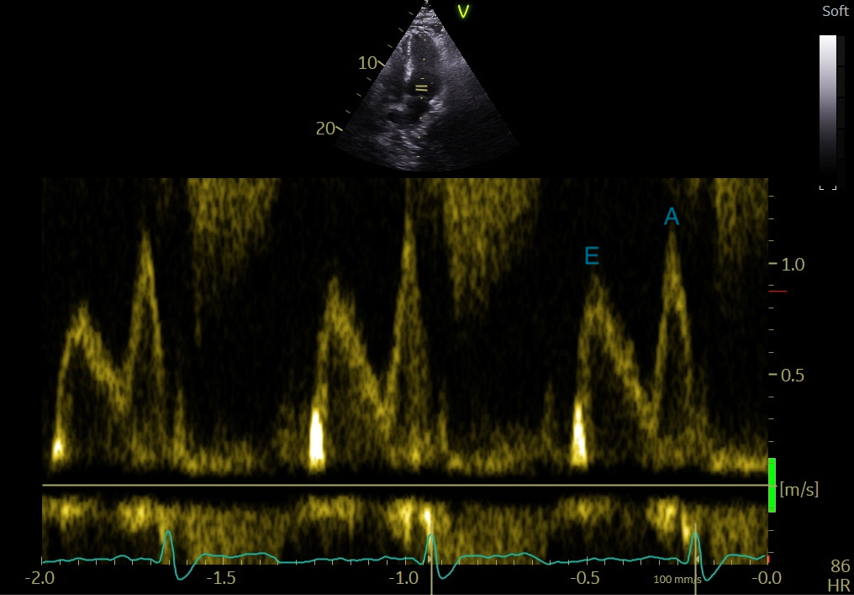
La coupe apicale des 4 cavités permet d’obtenir le doppler transmitral (en positionnant le curseur au sommet de l’ouverture de la valve mitrale en doppler pulsé), avec une onde E protodiastolique et une onde A télédiastolique) (Figure 25). Le rapport E/A mitral est > 1 chez le sujet normal et devient < 1 avec l’âge du fait d’une altération de la relaxation du VG.
Le DTI à l’anneau mitral (e’ septal et latéral) permet d’évaluer de façon non invasive les pressions de remplissage du VG (rapport E/moyenne des e’ septal et latéral > 14-15 en faveur d’une élévation des pressions de remplissage VG (Figures 8 et 9).
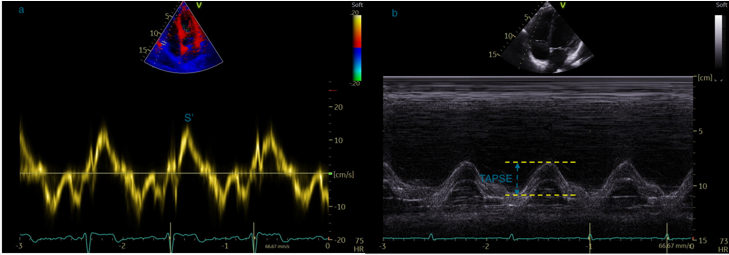
Le Doppler tissulaire au niveau l’anneau tricuspide permettra d’évaluer la fonction systolique longitudinale du VD par la mesure de l’onde S systolique (normale > 10 cm/s, figure 26).
Figure 25 : Incidence apicale, 4 cavités, enregistrement en Doppler pulsé du flux transmitral.
Le Doppler tissulaire au niveau de l’anneau tricuspide permettra d’évaluer la fonction systolique longitudinale du VD par la mesure de l’onde S systolique (normale > 10 cm/s, Figure 26a). Le mode TM à l’anneau tricuspide permet de mesurer le TAPSE également reflet de la fonction systolique longitudinale du VD (Figure 26b).
Figure 26 : Incidence apicale, 4 cavités, 26a : enregistrement de l’onde S’à l’anneau tricuspide en DTI. 26b : enregistrement du TAPSE en mode TM.
La coupe 5 cavités permet de de dégager l’aorte et la chambre de chasse du VG (Figure 22). L’enregistrement en doppler pulsé au niveau de la chambre de chasse du VG (ITvssAO) (Figure 5), combinée à la mesure de son diamètre en PSGA (Figure 14) permettra de calculer le volume d’éjection systolique et ainsi le débit cardiaque. L’enregistrement de la valve aortique en doppler continu permettra d’évaluer le caractère sténosant ou non de la valve aortique (Figure 6).
Le doppler couleur sur les valves permet de visualiser l’existence d’une fuite. Sur le flux d’insuffisance tricuspide (IT), un tir en doppler continu permet d’estimer la Vmax de l’IT et la PAPs (Figure 27).
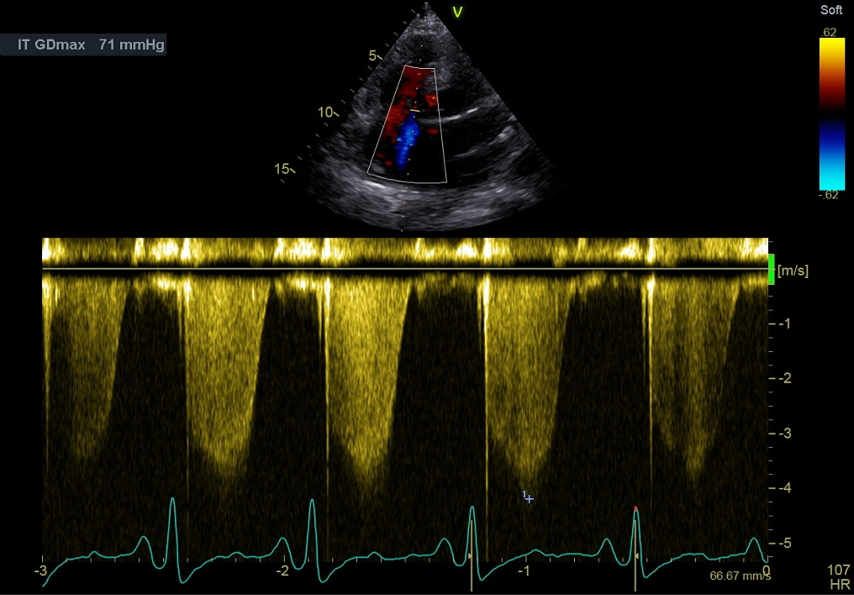
Figure 27: Coupe apicale, 4 cavités. Estimation de la Vmax de l’IT et de la PAPs en doppler continu sur le flux d’insuffisance tricuspide.
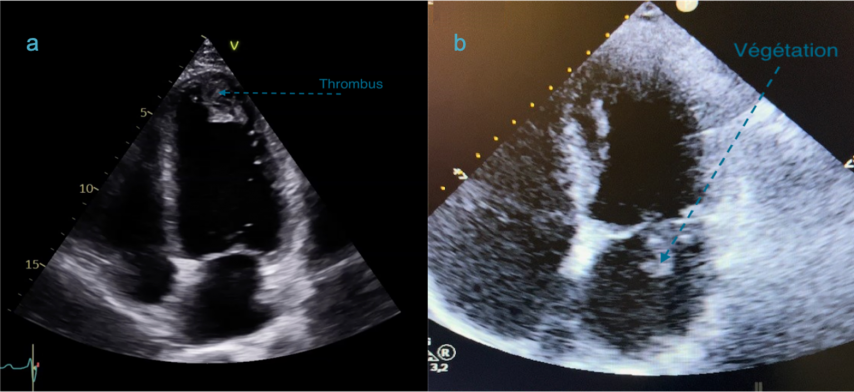
Les coupes apicales peuvent également permettre de déceler un thrombus le plus souvent au niveau apical (figure 28a) ou une végétation sur une valve dans le cadre d’une endocardite infectieuse (figure 28b). Certaines tumeurs cardiaques peuvent aussi être diagnostiquées.
Figure 28 : Coupe apicale, 4 cavités. 28a : visualisation d’un thrombus apical gauche. 28b : image de végétation sur la petite valve mitrale dans un contexte d’endocardite infectieuse.
La coupe 5 cavités permet de de dégager l’aorte et la chambre de chasse du VG (Figure 22).
- La fenêtre sous-costale ou sous-xiphoïdienne
La sonde d’échographie est positionnée sous la xyphoide sternale, curseur vers la gauche du patient (Figure 29). Elle permet de visualiser les 4 cavités cardiaques (Figure 30a). Cette coupe permet de visualiser un épanchement péricardique, avec une zone hypoéchogène entre le foie et le coeur droit correspondant à du liquide (Figure 30b). En déplacant le curseur à 45 degrés vers la droite du patient (positionné vers le haut), il s’agit d’un équivalent de coupe PSPA centrée sur la valve aortique (Figure 31). L’abouchement de la VCI dans l’OD est visualisé (Figure 32). Le diamètre en expiration de la VCI et sa compliance à l’inspiration permettent d’évaluer la volémie du patient.
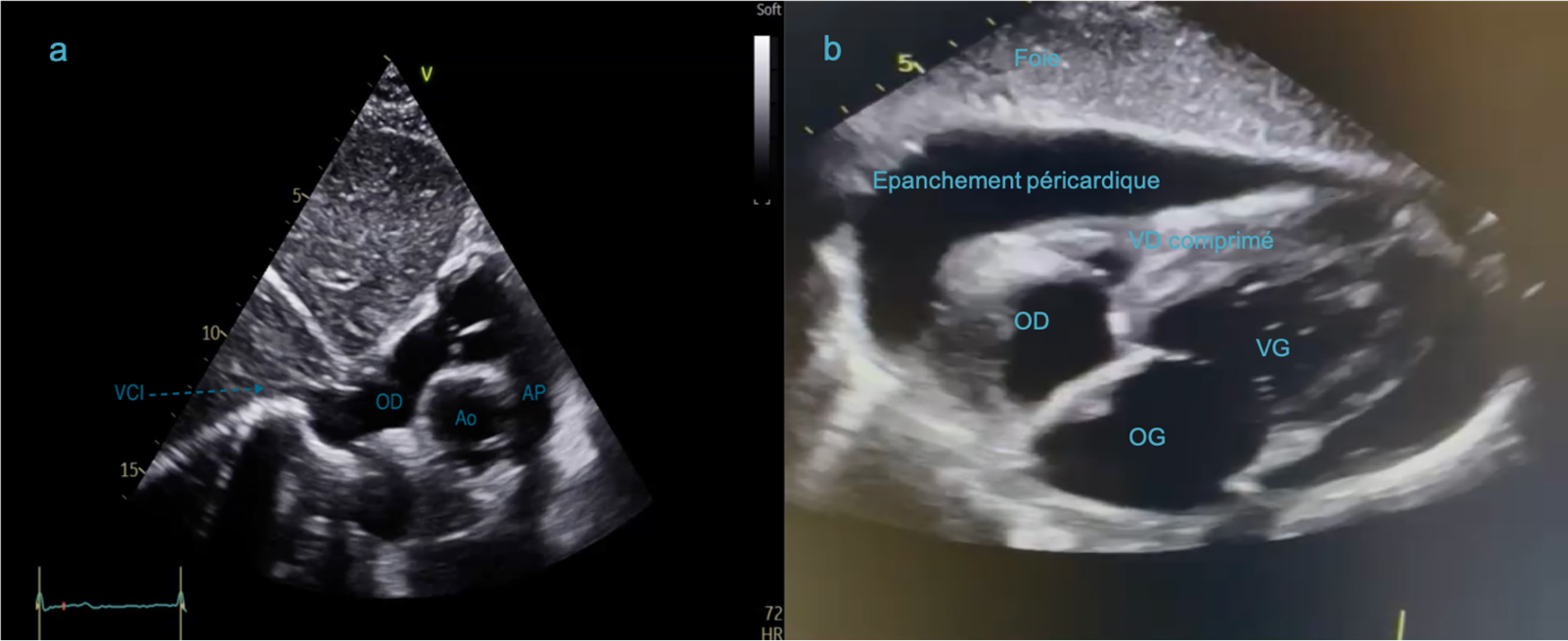
Figure 30: Incidence sous costale, 4 cavités. 30a : sous-costale sans épanchement. 30b : épanchement péricardique entre le foie et le coeur droit avec VD comprimé.
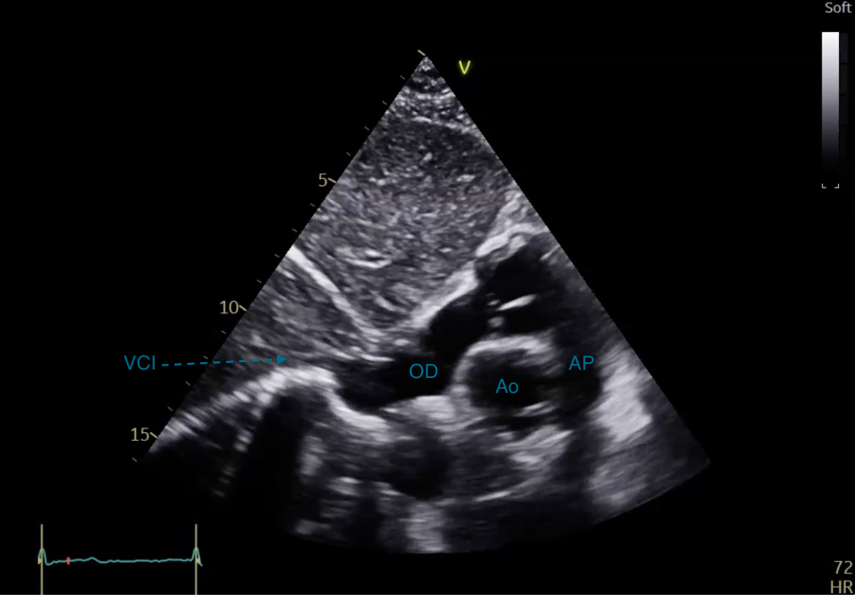
Figure 31 : Coupe sous costale orientée sur la valve aortique.
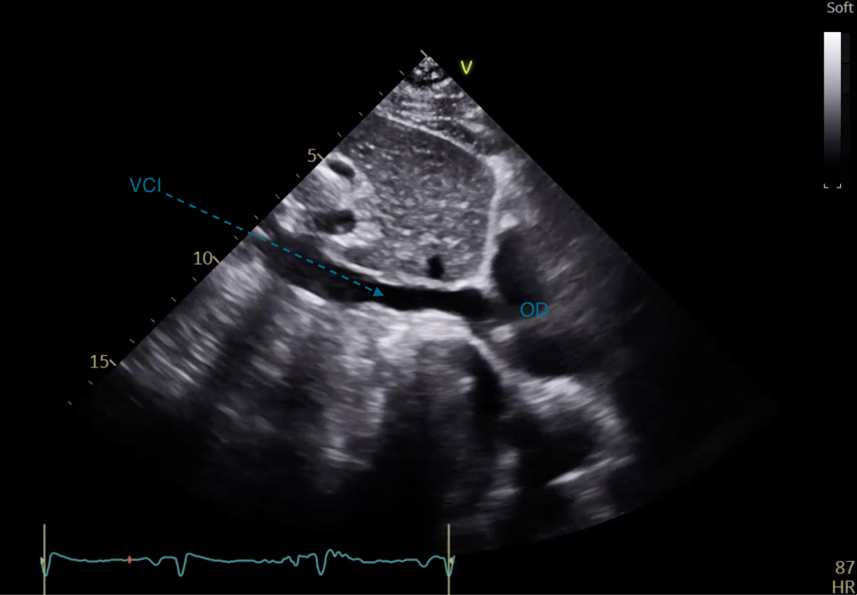
Figure 32 : Coupe sous costale, visualisation de la veine cave inférieure (VCI)
- La fenêtre supra sternale, permettant essentiellement de visualiser la crosse aortique
Figure 33 : Positionnement de la sonde d’échographie pour la fenêtre supra sternale
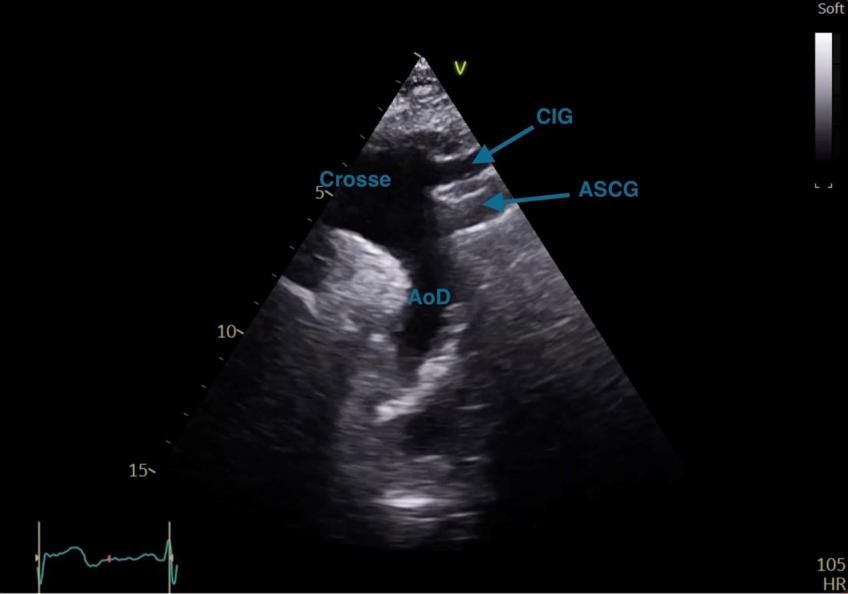
Figure 34 : Coupe suprasternale avec visualisation de l’aorte descendante (AoD)
CIG : Carotide Interne Gauche ; ASCG : Artère SubClavière Gauche
L’ETT permet de de diagnostiquer et de suivre les pathologies cardiovasculaires comme :
- L’hypertension artérielle (HTA)
- Les valvulopathies et prothèses valvulaires
- La cardiopathie ischémique
- L’insuffisance cardiaque
- Les cardiomyopathies
- Les pathologies du péricarde
- Les pathologies de l’aorte thoracique
- Les pathologies de la circulation pulmonaires (l’embolie pulmonaire et l’hypertension artérielle pulmonaire (HTAP)
- Les pathologies du cœur droit
L’apport diagnostique de l’ETT est conditionné par trois paramètres principaux : le type de matériel utilisé (qualité intrinsèque), la perméabilité du patient aux ultrasons et l’expérience de l’opérateur. L’échogénicité varie d’un patient à l’autre. Certains patients sont dits peu échogènes ou anéchogènes car ils sont peu perméables aux ultrasons (obésité, insuffisant respiratoire, déformation thoracique…).
Lorsqu’un patient est peu échogène, le médecin qui pratique l’échographie pourra s’aider d’un agent de contraste, par exemple le Sonovue®. Ce produit de contraste est composé de microbulles d’hexafluorure de soufre qui traversent le lit capillaire pulmonaire. Il permet d’améliorer l’échogénicité du sang car il améliore le rapport signal/bruit. Le cardiologue pourra donc visualiser plus distinctement le ventricule gauche et apprécier plus finement l’endocarde. Le Sonovue® pourra être utilisé en cas de doute sur la présence d’un thrombus intraventriculaire gauche ou pour évaluer avec certitude la fraction d’éjection ou la cinétique segmentaire du ventricule gauche. Le produit est utilisé en injection intraveineuse.
Avant toute injection de Sonovue®, il faudra rechercher si le patient n’a pas de contre-indications aux composants de Sonovue® et notamment informer le patient d’un risque anaphylactique rare mais grave.
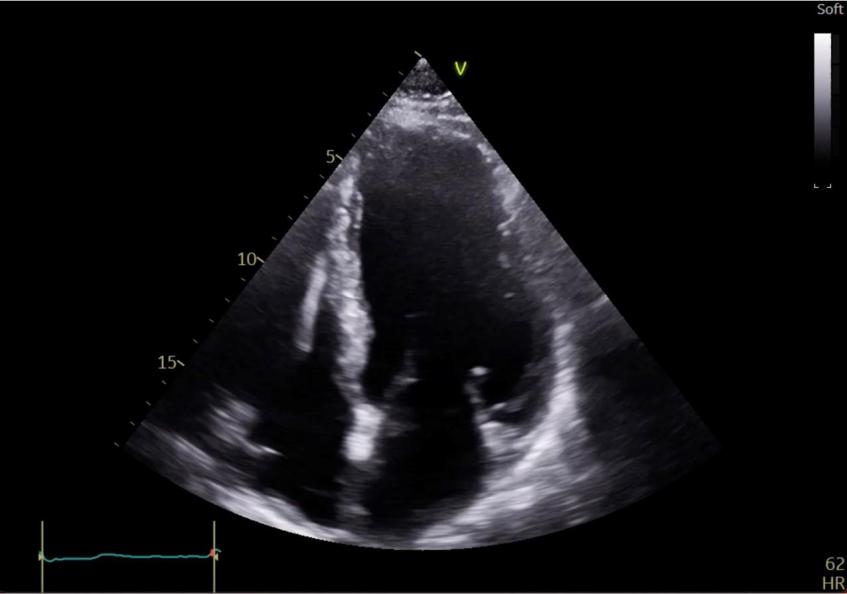
Figure 35 : Coupe apicale, 4 cavités, sans produit de contraste
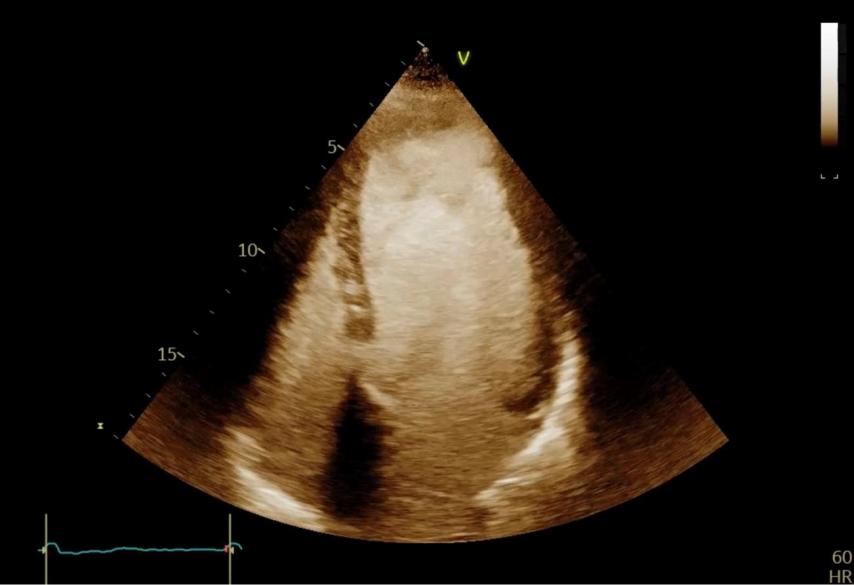
Figure 36 : Coupe apicale, 4 cavités, avec produit de contraste
L’ETT de stress
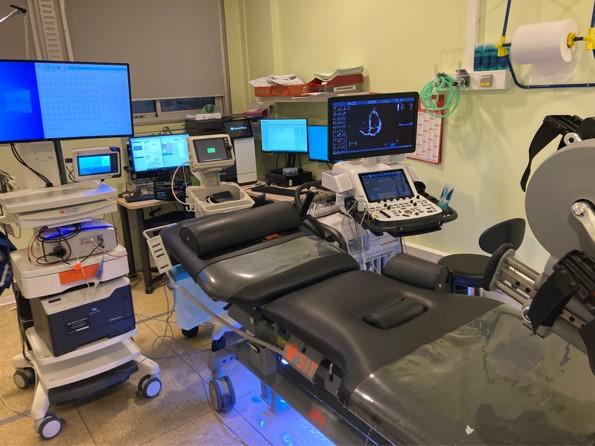
Figure 37 : Matériel nécessaire à la réalisation de l’échocardiographie d’effort sur ergomètre
L’échocardiographie de stress pharmacologique nécessite la mise en place d’une perfusion en intraveineuse pour le patient. La perfusion en continue et de manière progressive de Dobutamine permettra d’augmenter la consommation d’oxygène du myocarde. Elle induit à faible dose une augmentation de la contraction myocardique (effet inotrope positif sans augmentation significative de la fréquence cardiaque). A forte dose, elle entraine une augmentation de la fréquence cardiaque (effet chronotrope positif), sans élévation importante de la pression artérielle. Pour amplifier la réponse à la Dobutamine, le cardiologue pourra demander à l’infirmier(ière) d’administrer une ampoule d’Atropine (soit 0,25mg) qui pourra être injectée entre chaque palier, en n’excédant pas 1 mg et en s’assurant que le patient ne présente pas de contre-indication au produit (glaucome à angle aigu, antécédent de rétention aiguë d’urine essentiellement). Une fois l’échocardiographie trans thoracique faite, le cardiologue procédera à l’enregistrement de boucles du ventricule gauche en 4, 2 et 3 cavités et en PGA et PPA au repos, à faible intensité d’activité (en général + 10 bpm en fréquence cardiaque), au pic de l’effort lorsque le patient a atteint la FMT puis en récupération.Une fois les acquisitions faites, le cardiologue demandera à l’infirmier(ière) de stopper la perfusion de Dobutamine et d’injecter un bêtabloquant (typiquement Atenolol 1 à 2 mg) ou un inhibiteur calcique (Diltiazem le plus souvent) si le patient présente une contre-indication aux bêtabloquants.
Quelle que soit la modalité, l’analyse des boucles acquises sera réunie en quad screen (relecture des acquisitions réalisées au repos, en début de test, au pic et en récupération sur un même écran) permettant au cardiologue d’observer et d’analyser la contractilité myocardique qui repose sur l’étude d’épaississement systolique pariétal et le déplacement de l’endocarde (figure 38). Une réduction de l’épaississement systolique correspond à une hypokinésie alors que l’absence complète d’épaississement est une akinésie . Enfin un mouvement systolique paradoxal (vers l’extérieur de la cavité ventriculaire gauche) est une dyskinésie. C’est l’analyse de l’évolution de la cinétique au cours du test qui permet de porter le diagnostic d’ischémie en voyant apparaître une hypo-, a- ou dyskinésie dans une région normocontractile à l’état basal.
L’échocardiographie de stress est un examen combinant une échographie transthoracique (ETT) et un stress soit physiologique (par l’effort), soit pharmacologique via un médicament administré par une perfusion (la Dobutamine).
Le but est de rechercher une ischémie myocardique de manière non invasive en atteignant au moins 85% de la fréquence maximale théorique (FMT) (soit 220 bpm - âge du patient,) à l’effort, et 100% de la FMT sous Dobutamine. En effet, le double produit (produit fréquence x pression artérielle qui est le reflet de la consommation myocardique) est moins élevé sous Dobutamine, du fait de la moindre élévation de la pression artérielle, qu’à l’effort, obligeant à atteindre dans ce cadre des niveaux de fréquence plus élevés. En cas de lésions coronaires, il y aura un déséquilibre entre les besoins et les apports en oxygène du myocarde, ce qui entrainera des manifestations cliniques comme la douleur thoracique, des modifications électrocardiographiques (ECG) et l’apparition de troubles de la cinétique segmentaire (hypokinésie, akinésie, dyskinésie). Les anomalies de cinétique précèdent les anomalies de l’ECG, elles-mêmes précédant la survenue d’une douleur thoracique, ce qui souligne la plus grande sensibilité de l’ETT de stress que l’ECG d’effort pour le diagnostic de maladie coronaire.
Le déroulé de l’ETT de stress pharmacologique et d’effort est similaire. Une fois l’ETT de repos faite, le cardiologue procédera à l’enregistrement de boucles du ventricule gauche sur 1 cycle cardiaque, en 4, 2 et 3 cavités ainsi qu’en PSGA et PSPA : au repos, à + 10 bpm en fréquence, au pic du stress/effort à la FMT et en récupération.
L’échocardiographie d’effort est réalisée sur un ergomètre (Figure 37)
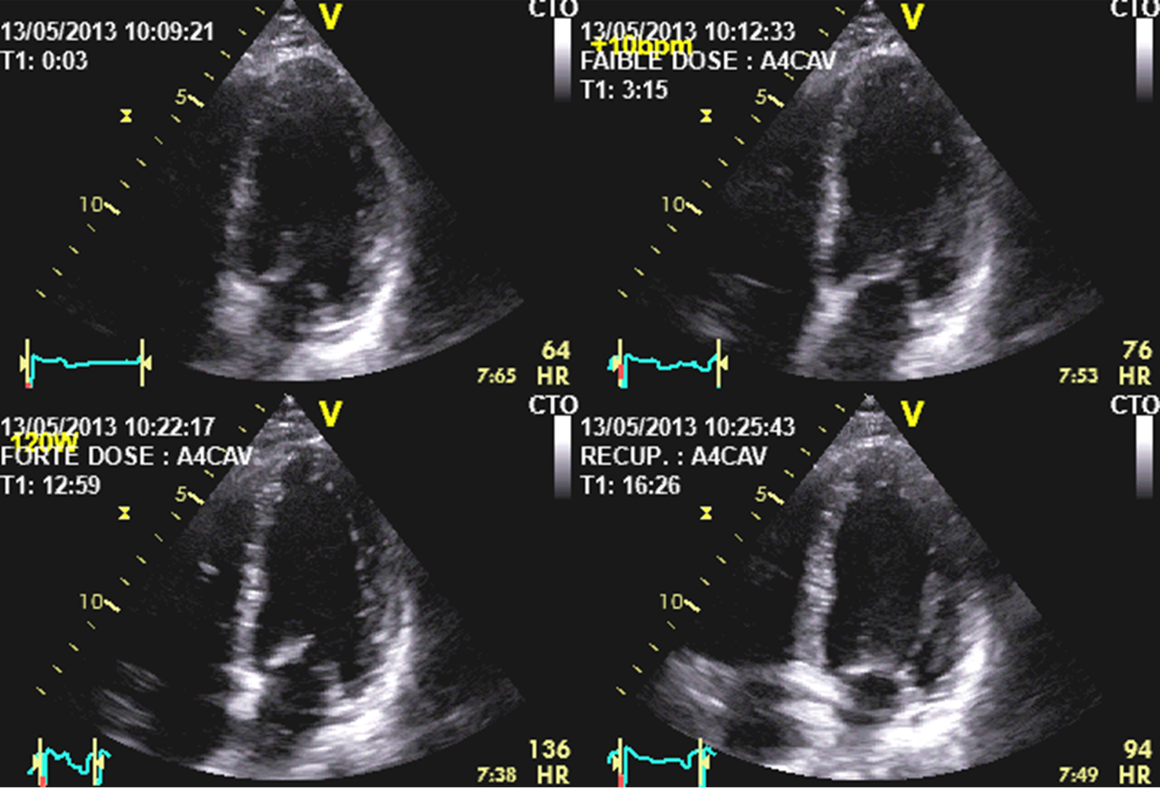
Figure 38 : Quad Screen sur une coupe apicale 4 cavités.
L’échocardiographie de stress est préconisée pour :
- Dépister la maladie coronaire
- Evaluer l’étiologie cardiaque d’une dyspnée d’effort
- Evaluer le risque pré-opératoire avant une chirurgie nécessitant une anesthésie générale.
- Localiser l’ischémie myocardique
- Détecter la viabilité (faible dose de Dobutamine) myocardique après un infarctus du myocarde.
- Évaluer la sévérité d’une sténose valvulaire: en cas de rétrécissement aortique en bas débit, on peut réaliser un examen sous Dobutamine mais à faible dose (objectif d’augmentation de la fréquence cardiaque de dix battements) afin de mobiliser la réserve contractile et vérifier que la sténose aortique est bien fixée.
L’échocardiographie de stress à l’effort sera toujours privilégiée au stress pharmacologique sauf :
- Si le patient présente un bloc de bloc gauche (BBG) sur son électrocardiogramme
- Si le patient présente une contre-indication à l’effort
- Si le patient a une artériopathie des membres inférieurs symptomatique
- Si on recherche la viabilité myocardique et en cas de sténose aortique en bas débit.
Le cardiologue pourra utiliser un agent de contraste pendant les échocardiographies de stress (effort ou pharmacologique) lorsqu’au moins deux segments myocardiques contigus sont non ou mal visualisés.
L’Echocardiographie Trans Œsophagienne (ETO)
Elle est complémentaire à l’échographie transthoracique dans un certain nombre de situations cliniques.
On introduit, par la bouche, une sonde munie de capteurs ultrasonores jusque dans l’œsophage.
La sonde utilisée est un endoscope muni à son extrémité d’un capteur émettant des ultrasons de hautes fréquences, permettant d’obtenir des images de haute résolution (Figure 39), dans la mesure où l’œsophage est en contact direct avec la partie postérieure de l’oreillette gauche, sans interposition d’autres structures gênant la progression des ultrasons. Par conséquent, le signal échographique n’est pas perturbé par le sternum, les côtes ou autres structures graisseuses ou aériennes.
C’est un acte semi invasif.
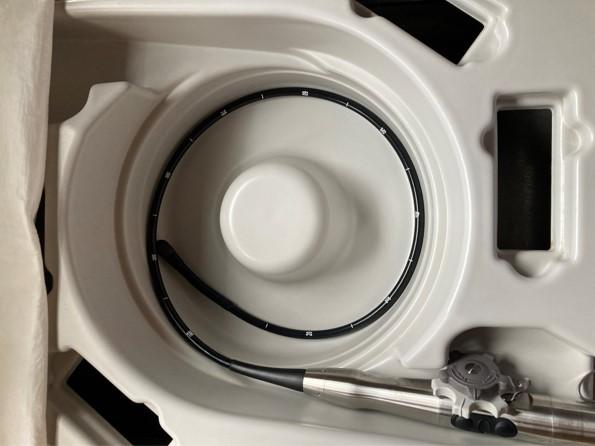
Figure 39 : Sonde ETO
Cet examen nécessite que le patient soit à jeun depuis 6 heures (4 heures en situation d’urgence).
Les indications principales sont :
- La recherche d’une infection des valves cardiaques (endocardite infectieuse)
- L’étude des prothèses valvulaires et matériel intracardiaque
- La recherche d’un thrombus intracardiaque (figure 40) notamment dans l’auricule gauche ou d’un Foramen Ovale Perméable (FOP) (figure 41) suite à un Accident Vasculaire Cérébral (AVC) ou avant une cardioversion chez un (e) patient (e) en fibrillation atriale
- L’exploration des gros vaisseaux (par exemple recherche d’une dissection aortique)
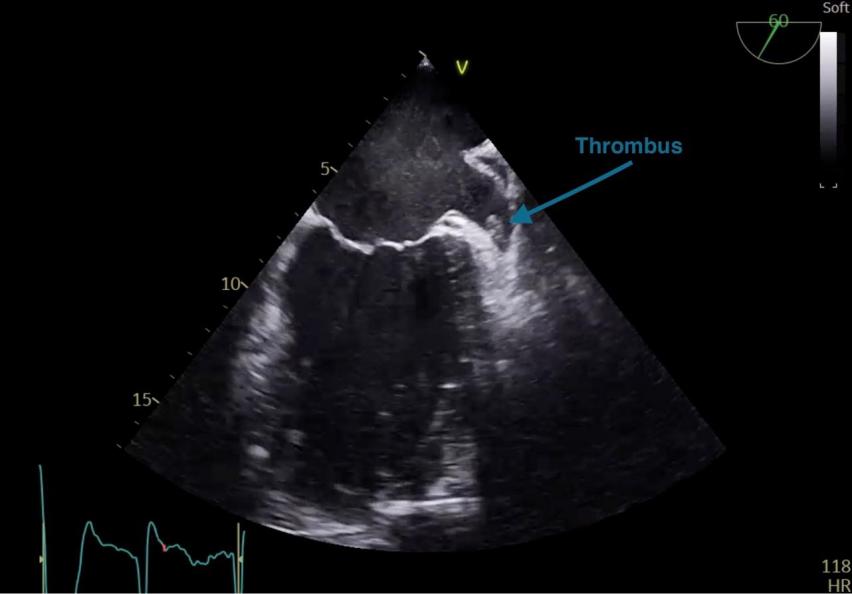
Figure 40 : Visualisation d’un thrombus dans l’auricule gauche en ETO
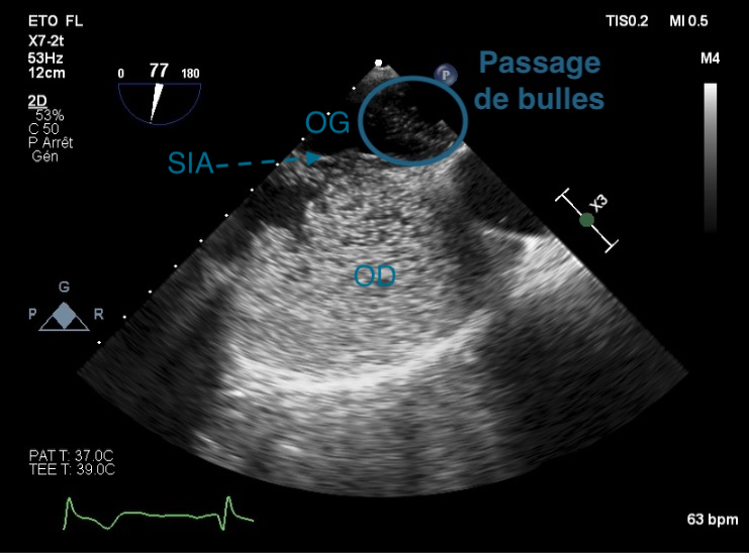
Figure 41 : Épreuve de contraste en ETO : Visualisation d’un Foramen Ovale Perméable, avec passage de microbulles de l’oreillette gauche (OG) vers l’oreillette droite (OD).
SIA : Septum InterAtrial
L’ETO permet également de guider certaines procédures interventionnelles non chirurgicales structurelles comme les fermetures de Foramen Ovale Perméable (FOP) (image avant après : figures 42 - 43) ou de communication interatriale, les exclusions d’auricule gauche mais aussi en cas de gestes percutanés valvulaires (réparation mitrale par clip par exemple) en obtenant une vue en 3D depuis l’oreillette gauche qui mime la vue du chirurgien cardiaque (Figure 44).
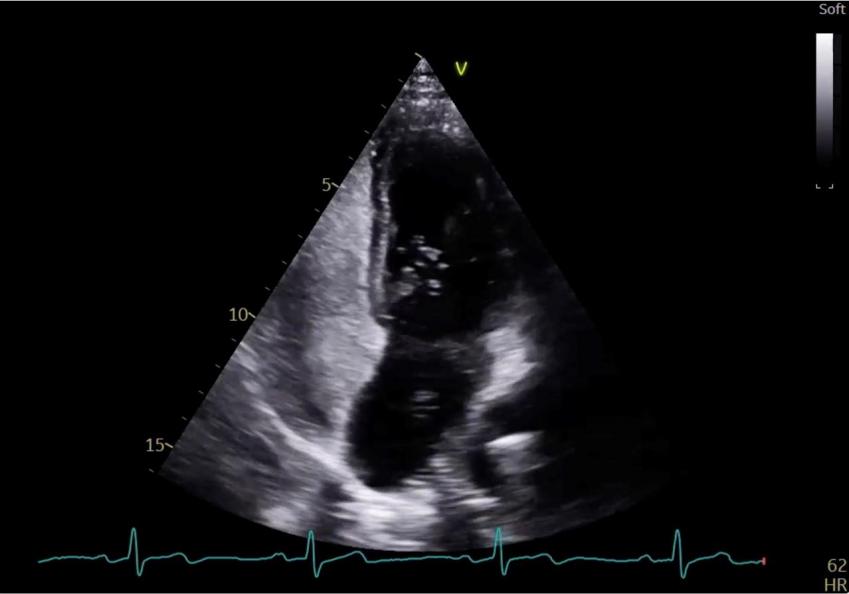
Figure 42 : Épreuve de contraste en ETT, Présence d’un FOP
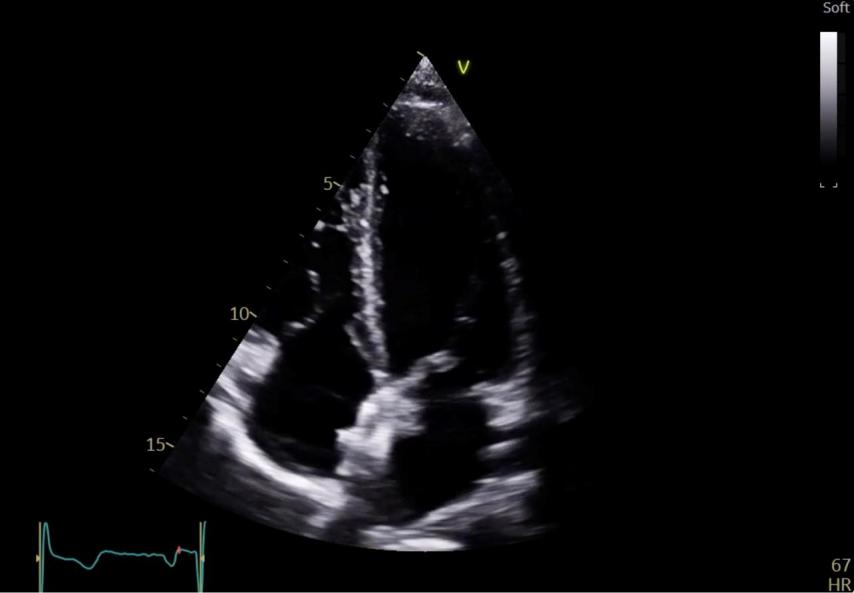
Figure 43 : Visualisation d’une prothèse de type Amplatzer après fermeture du FOP
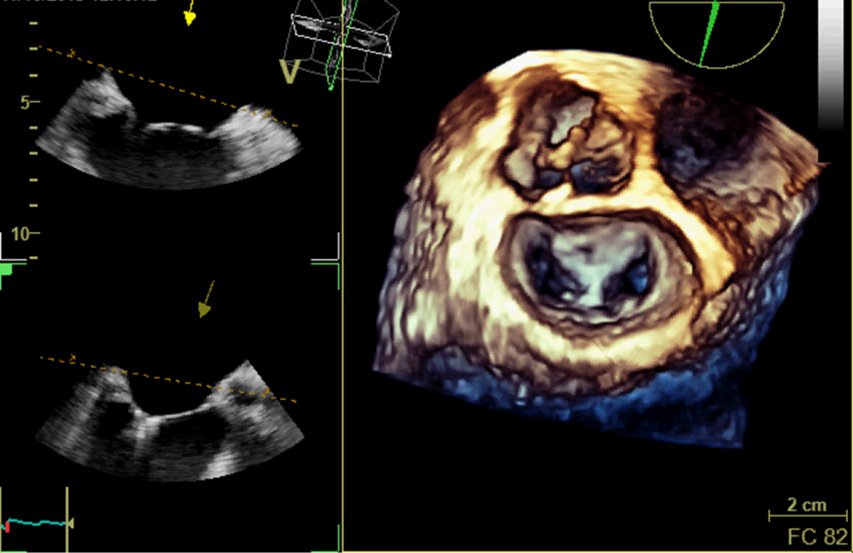
Figure 44 : Vue chirurgicale de la valve mitrale en ETO 3D, lors d’une réparation mitrale percutanée bord à bord d’un prolapsus de la partie médiane de la valve postérieure à l’aide d’un clip mitral. Notez l’aspect de double orifice mitral résiduel.
Conclusion :
L’échocardiographie fournit aux cliniciens des informations extrêmement précieuses et multiples. C’est un outil non invasif, permettant de poser un diagnostic, d’optimiser et d’orienter la thérapeutique d’un patient mais aussi de donner une vision sur son pronostic (atteinte d’une valve, insuffisance cardiaque…). L’apparition récente d’échographes portables et ultraportables augmente le champ des applications de cette technique au quotidien au-delà des laboratoires d’échocardiographie en permettant un véritable prolongement de l’examen clinique.
Remerciements : Pr Sylvestre Maréchaux, Dr Clémence Riolet
Bibliographie:
Ariel Cohen – Laurie Soulat-Dufour ,«échocardiographie en pratique»,Paris,Lavoisier 2017,600 pages
Tribouilloy C.,Bohbot Y.,Szymanski C.,«Guide pratique d’échocardiographie» ,Issy-les -Moulineaux, 2021, 474 pages
Vous devez être connecté pour poster un commentaire